题目内容
3. K3[Fe(C2O4)3]•3H2O[三草酸合铁(Ⅲ)酸钾晶体]易溶于水,难溶于乙醇,可作为有机反应的催化剂.实验室可用废铁屑等物质为原料制备,并测定产品的纯度.相关反应的化学方程式为:
K3[Fe(C2O4)3]•3H2O[三草酸合铁(Ⅲ)酸钾晶体]易溶于水,难溶于乙醇,可作为有机反应的催化剂.实验室可用废铁屑等物质为原料制备,并测定产品的纯度.相关反应的化学方程式为:Fe+H2SO4=FeSO4+H2↑
FeSO4+H2C2O4+2H2O=FeC2O4•2H2O↓+H2SO4
2FeC2O4•2H2O+H2O2+H2C2O4+3K2C2O4=2K3[Fe(C2O4)3]+6H2O
回答下列问题:
(1)使用废铁屑前,往往将其在1.0mol•L-1 Na2CO3溶液中浸泡数分钟,其目的是除去铁屑表面的油污.然后使用倾析法(填写操作名称)分离并洗涤铁屑.
(2)析出的K3[Fe(C2O4)3]•3H2O晶体可通过如图所示装置通过减压过滤与母液分离.下列关于减压过滤的操作正确的是AD.
A.选择比布氏漏斗内径略小又能将全部小孔盖住的滤纸
B.放入滤纸后,直接用倾析法转移溶液和沉淀,再打开水龙头抽滤
C.洗涤晶体时,先关闭水龙头,用蒸馏水缓慢淋洗,再打开水龙头抽滤
D.抽滤完毕时,应先断开抽气泵和吸滤瓶之间的橡皮管,以防倒吸
(3)使用高锰酸钾法(一种氧化还原反应滴定法)可以测定所得产品的纯度.若需配制浓度为0.03000mol•L-1 KMnO4标准溶液240mL,应准确称取1.185g KMnO4(保留四位有效数字,已知M KMnO4=158.0g•mol-1).配制该标准溶液时,所需仪器除电子天平、药匙、烧杯、玻璃棒外,还缺少的玻璃仪器有250mL容量瓶、胶头滴管.配制过程中,俯视刻度线定容则导致所配溶液浓度偏大(填“偏大”、“偏小”或“无影响”).
(4)某同学称取2.000g产品,经预处理后配制成100mL溶液,移取25.00mL溶液于锥形瓶中,使用0.03000mol•L-1KMnO4标准溶液滴定,消耗标准溶液10.00mL.
①实际进行滴定时,往往使用酸化的KMnO4标准溶液,写出该滴定反应的离子方程式5C2O42-+2MnO4-+16H+=10CO2+2Mn2++8H2O.
②判断到达滴定终点的现象是加入最后一滴KMnO4标准溶液后,溶液呈浅红色,且30s内不变化.
③该产品的纯度为24.55%%(保留四位有效数字)
分析 (1)铁屑表面有油污,碳酸钠是强碱弱酸盐,溶液显碱性,可以除去铁屑表面的油污;由于铁是金属,不溶于水,可以使用倾析法分离并洗涤铁屑;
(2)A.滤纸大时,滤纸边缘与漏斗产生缝隙,使过滤速度慢,沉淀抽不干,滤纸小时,滤纸不能盖住所有孔,不能过滤;
B.放入滤纸后,用玻璃棒引流来转移溶液和沉淀,再打开水龙头抽滤;
C.洗涤晶体时,先关闭水龙头,用蒸馏水缓慢淋洗,再微接水龙头,将洗涤液慢慢透过全部晶体;
D.抽滤完毕时,应先断开抽气泵和吸滤瓶之间的橡皮管,以防倒吸;
(3)由于没有240ml容量瓶,所以应该配制250mL高锰酸钾溶液,根据n=cV计算高锰酸钾的物质的量,根据m=nM计算需要高锰酸钾的质量;
配制该标准溶液时,所需仪器除电子天平、药匙、烧杯、玻璃棒外,还缺少的玻璃仪器有250mL容量瓶、胶头滴管;
配制过程中,俯视刻度线定容则导致容量瓶中溶液的体积偏少,因此所配溶液浓度偏大;
(4)①反应中碳元素的化合价从+3价升高到+4价失去1个电子,而Mn元素的化合价从+7价降低到+2价得到5个电子,因此根据电子得失守恒可知氧化剂与还原剂的物质的量之比是2:5,则根据原子守恒、电荷守恒配平后的方程式;
②由于酸性高锰酸钾溶液显紫红色,加入最后一滴KMnO4标准溶液后,溶液呈浅红色,且30s内不变化,说明到达终点;
③根据①中方程式计算参加反应的草酸根的物质的量,根据碳元素守恒计算2.000g样品中K3[Fe(C2O4)3]•3H2O的质量,进而计算样品纯度.
解答 解:(1)铁屑表面有油污,而碳酸钠是强碱弱酸盐,溶液显碱性,所以使用废铁屑前,往往将其在1.0mol.L-1Na2CO3溶液中浸泡数分钟的目的是除去铁屑表面的油污;由于铁是金属,不溶于水,所以可以使用倾析法分离并洗涤铁屑,
故答案为:除去铁屑表面的油污;倾析法;
(2)A.选择比布氏漏斗内径略小又能将全部小孔盖住的滤纸,滤纸大时,滤纸边缘与漏斗产生缝隙,使过滤速度慢,沉淀抽不干,滤纸小时,滤纸不能盖住所有孔,不能过滤,故A正确;
B.放入滤纸后,用玻璃棒引流来转移溶液和沉淀,再打开水龙头抽滤,故B错误;
C.洗涤晶体时,先关闭水龙头,用蒸馏水缓慢淋洗,再微接水龙头,将洗涤液慢慢透过全部晶体,故C错误;
D.抽滤完毕时,应先断开抽气泵和吸滤瓶之间的橡皮管,以防倒吸,故D正确,
故选:AD;
(3)由于没有240ml容量瓶,所以应该配制250ml高锰酸钾溶液,则需要高锰酸钾的质量是0.03000 mol•L-1×0.25L×158g/mol=1.185g;
配制该标准溶液时,所需仪器除电子天平、药匙、烧杯、玻璃棒外,还缺少的玻璃仪器有250mL容量瓶、胶头滴管;配制过程中,俯视刻度线定容,液面在刻度线下方,导致容量瓶中溶液的体积偏少,因此所配溶液浓度偏大,
故答案为:1.185;250mL容量瓶、胶头滴管;偏大;
(4)①反应中碳元素的化合价从+3价升高到+4价失去1个电子,而Mn元素的化合价从+7价降低到+2价得到5个电子,因此根据电子得失守恒可知氧化剂与还原剂的物质的量之比是2:5,则根据原子守恒、电荷守恒可知,配平后的方程式为:5C2O42-+2MnO4-+16H+=10CO2+2Mn2++8H2O,
故答案为:5C2O42-+2MnO4-+16H+=10CO2+2Mn2++8H2O;
②由于酸性高锰酸钾溶液显紫红色,所以判断到达滴定终点的现象是:加入最后一滴KMnO4标准溶液后,溶液呈浅红色,且30s内不变化,
故答案为:加入最后一滴KMnO4标准溶液后,溶液呈浅红色,且30s内不变化;
③根据方程式可知,参加反应的草酸根的物质的量是0.03000 mol•L-1×0.01L×$\frac{5}{2}$=0.0007500mol,所以2.000g样品中K3[Fe(C2O4)3]•3H2O的质量是0.0007500mol×$\frac{1}{3}$×491/mol×=0.491g,所以纯度为$\frac{0.491g}{2.000g}$×100%=24.55%,
故答案为:24.55%.
点评 本题以实验制备为载体,考查学生对操作的分析评价、物质的分离提纯、溶液配制、氧化还原反应滴定等,是对学生综合能力的考查,难度中等.

| A. | 石灰水 | B. | Cu | C. | NaCl | D. | 蔗糖 |
| A. | 用浓盐酸配制稀盐酸时,一般用托盘天平称量所需的浓盐酸 | |
| B. | 将烧杯中的浓硫酸加水稀释,须等溶液冷却至室温后再转移到容量瓶中 | |
| C. | 量取浓盐酸的量筒需用蒸馏水洗净后,也需将洗涤液倒入烧杯中加水稀释 | |
| D. | 容量瓶不可长时间保存溶液 |
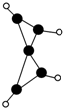 科学家最近在-100℃的低温下合成一种烃X,此分子的结构如图所示(图中的连线表示化学键).下列说法正确的是( )
科学家最近在-100℃的低温下合成一种烃X,此分子的结构如图所示(图中的连线表示化学键).下列说法正确的是( )| A. | X既能使溴的四氯化碳溶液褪色又能使酸性KMnO4溶液褪色 | |
| B. | X是一种常温下能稳定存在的液态烃 | |
| C. | X和乙烷类似,都容易发生取代反应 | |
| D. | 充分燃烧等质量的X和甲烷,甲烷消耗氧气较多 |
 己知A,B、C、D,E五种元素的原子序数依次增大,A元素位于周期表的s区.其原子中电子层数等于未成对电子数:B的基态原子中电子占据三种能量不同的原子轨道,且每种原子轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3 倍. A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,AB两种元素成的原子个数之比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+和氩原子的核外电子抹布相同.
己知A,B、C、D,E五种元素的原子序数依次增大,A元素位于周期表的s区.其原子中电子层数等于未成对电子数:B的基态原子中电子占据三种能量不同的原子轨道,且每种原子轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3 倍. A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,AB两种元素成的原子个数之比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+和氩原子的核外电子抹布相同.