��Ŀ����
����Ŀ����������ת����ϵ(���ַ�Ӧ��������������ȥ)��A��B��C��D�о�����ͬһ��Ԫ�أ��ش��������⣺

��1����B����ʹƷ����Һ��ɫ�����壬д��D��Ũ��Һ��Cu�ڼ�������·�Ӧ�Ļ�ѧ����ʽ_______________________________��
��2����A��N2����
��Bת��ΪC������_______________________________��
��д������Fe��D��ϡ��Һ��Ӧ����ԭ����ֻ��B�������ӷ���ʽ_______________________________��
��3����A����ʹʪ��ĺ�ɫʯ����ֽ���������壬��
������O2 �ڸ��¡������������·�Ӧ����B���˻�ѧ����ʽΪ
_______________________________��
��д��ʵ�����ù�����ȡA����Ļ�ѧ����ʽ_______________________________��
����Ҫ�ռ�B���壬�����ռ�װ���к��ʵ���(�����)______________��

��1.92gͭͶ��һ����D��Ũ��Һ�У�ͭ��ȫ�ܽ⣬���ռ���672mL����(��״��)����Ӧ������D �����ʵ���Ϊ_____________��
���𰸡� Cu��2H2SO4(Ũ)![]() CuSO4��SO2����2H2O ��ɫ�����Ϊ����ɫ 3Fe��8H����2NO3�� === 3Fe2����2NO����4H2O 4NH3+5O2
CuSO4��SO2����2H2O ��ɫ�����Ϊ����ɫ 3Fe��8H����2NO3�� === 3Fe2����2NO����4H2O 4NH3+5O2 ![]() 4NO+6H2O 2NH4Cl��Ca(OH)2
4NO+6H2O 2NH4Cl��Ca(OH)2![]() CaCl2��2NH3����2H2O C��E 0.09mol
CaCl2��2NH3����2H2O C��E 0.09mol
���������������⣺
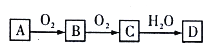
��1����B����ʹƷ����Һ��ɫ������������������Ӧ������֪BΪ����������A������������ȼ�����ɶ�����������������������������CΪ������������������ˮ��Ӧ����DΪ���ᡣŨ������Cu�ڼ�������·�Ӧ�Ļ�ѧ����ʽΪCu��2H2SO4(Ũ)![]() CuSO4��SO2����2H2O����2����A��N2��������������Ӧ����BΪһ��������һ��������������Ӧ����CΪ��������������������ˮ��Ӧ����DΪ�����һ����������Bת��ΪC������Ϊ����ɫ�����Ϊ����ɫ���ڹ���Fe��ϡ���ᷴӦ����ԭ����ֻ��NO�������ӷ���ʽΪ3Fe��8H����2NO3�� = 3Fe2����2NO����4H2O����3����A����ʹʪ��ĺ�ɫʯ����ֽ���������弴��������ٰ�����O2 �ڸ��¡������������·�Ӧ����NO��ˮ ����Ӧ�Ļ�ѧ����ʽΪ4NH3+5O2
CuSO4��SO2����2H2O����2����A��N2��������������Ӧ����BΪһ��������һ��������������Ӧ����CΪ��������������������ˮ��Ӧ����DΪ�����һ����������Bת��ΪC������Ϊ����ɫ�����Ϊ����ɫ���ڹ���Fe��ϡ���ᷴӦ����ԭ����ֻ��NO�������ӷ���ʽΪ3Fe��8H����2NO3�� = 3Fe2����2NO����4H2O����3����A����ʹʪ��ĺ�ɫʯ����ֽ���������弴��������ٰ�����O2 �ڸ��¡������������·�Ӧ����NO��ˮ ����Ӧ�Ļ�ѧ����ʽΪ4NH3+5O2 ![]() 4NO+6H2O����ʵ�����ù����Ȼ�狀��������Ƽ�����ȡ������ͬʱ�����Ȼ��ƺ�ˮ����Ӧ�ĵĻ�ѧ����ʽΪ2NH4Cl��Ca(OH)2
4NO+6H2O����ʵ�����ù����Ȼ�狀��������Ƽ�����ȡ������ͬʱ�����Ȼ��ƺ�ˮ����Ӧ�ĵĻ�ѧ����ʽΪ2NH4Cl��Ca(OH)2![]() CaCl2��2NH3����2H2O����BΪһ��������һ������������ˮ����ˮ��Ӧ������Ⱦ�����壬�ܶȱȿ���С������Ҫ�ռ�NO���壬�����ռ�װ����A��B������ɿ�����Ⱦ������������Ӧ�������ϣ�C��ˮ���ռ������ϣ�DΪ��ˮ���ռ�������Ӧ�ö̽������������ϣ�EΪ��ˮ���ռ��ҵ���Ӧ�ý����������ϣ��ʺ��ʵ���CE����һ��������������Ӧ����C Ϊ��������������������ˮ��Ӧ����DΪ���ᣬ 1.92gͭͶ��һ����Ũ�����У�ͭ��ȫ�ܽ⣬���ռ���672mL����(��״��)��672ml����Ӧ����NO2 ��NO�Ļ������ʵ�����
CaCl2��2NH3����2H2O����BΪһ��������һ������������ˮ����ˮ��Ӧ������Ⱦ�����壬�ܶȱȿ���С������Ҫ�ռ�NO���壬�����ռ�װ����A��B������ɿ�����Ⱦ������������Ӧ�������ϣ�C��ˮ���ռ������ϣ�DΪ��ˮ���ռ�������Ӧ�ö̽������������ϣ�EΪ��ˮ���ռ��ҵ���Ӧ�ý����������ϣ��ʺ��ʵ���CE����һ��������������Ӧ����C Ϊ��������������������ˮ��Ӧ����DΪ���ᣬ 1.92gͭͶ��һ����Ũ�����У�ͭ��ȫ�ܽ⣬���ռ���672mL����(��״��)��672ml����Ӧ����NO2 ��NO�Ļ������ʵ�����![]() ��0.03mol����Ӧ����������ͭ��n(NO3-)=2n(Cu2+)=
��0.03mol����Ӧ����������ͭ��n(NO3-)=2n(Cu2+)=![]() �����ݵ�ԭ���غ��֪����Ӧ������Ũ��������ʵ���Ϊ0.03mol+0.06mol=0.09mol��
�����ݵ�ԭ���غ��֪����Ӧ������Ũ��������ʵ���Ϊ0.03mol+0.06mol=0.09mol��

