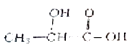��Ŀ����
����Ŀ����ͼ��ʵ�����Ʊ����Ȼ���Һ���װ�á���֪�����Ȼ����۵�Ϊ-70�棬�е�57.6�棬��ˮ����Ӧ��

��ش��������⡣
��1��д��װ��A�з�����Ӧ�����ӷ���ʽ_______________________________��
��2��8.7 g MnO2 ��������Ũ���ᷴӦ�����б�������HCl�����ʵ���Ϊ____________mol��
��3��װ��B��ʢ�ŵ��Լ���__________________��
��4��g�ܵ�������_________________��
��5��װ��E�б�ˮ��������_________________��
��6�������F�м�ʯ�ҵ�������______________��_________________��
���𰸡� MnO2+4H++2Cl-![]() Mn2++Cl2��+2H2O 0.2mol ����ʳ��ˮ ʹ��Һ˳������ ������ȴSiCl4���� ���ն������� ��ֹ�����е�ˮ��������hװ�������Ȼ��跴Ӧ
Mn2++Cl2��+2H2O 0.2mol ����ʳ��ˮ ʹ��Һ˳������ ������ȴSiCl4���� ���ն������� ��ֹ�����е�ˮ��������hװ�������Ȼ��跴Ӧ
����������1��AΪ����������Ũ�����ڼ����������Ʊ�������װ�ã�����ʽΪMnO2+4H++2Cl- ![]() Mn2++Cl2��+2H2O����2��8.7g����������0.1mol�����ݷ���ʽ��֪����0.1mol��������������HCl�����ʵ���Ϊ0.2mol����3���Ƶõ������л��HCl��ˮ������B���ñ���ʳ��ˮ����HCl���壻��4��Ũ�����лӷ��ԣ��ʷ�Һ©��Ҫ�Ӹǣ��ӸǺ���û��g�ܣ�������Ͳ�������ȥ������g�ܵ�������ƽ��ѹǿ��ʹҺ��˳����������5�����Ȼ���ķе�ͣ���Eװ���б�ˮ�������ǿ�����ȴSiCl4��������6�����Ȼ�����ˮ��Ӧ����װ��ӦΪ��ˮ��������Ӧ�е�������Ⱦ������Ӧ���գ���F�м�ʯ�ҵ����������ն��������ͷ�ֹ�����е�ˮ��������hװ�������Ȼ��跴Ӧ��
Mn2++Cl2��+2H2O����2��8.7g����������0.1mol�����ݷ���ʽ��֪����0.1mol��������������HCl�����ʵ���Ϊ0.2mol����3���Ƶõ������л��HCl��ˮ������B���ñ���ʳ��ˮ����HCl���壻��4��Ũ�����лӷ��ԣ��ʷ�Һ©��Ҫ�Ӹǣ��ӸǺ���û��g�ܣ�������Ͳ�������ȥ������g�ܵ�������ƽ��ѹǿ��ʹҺ��˳����������5�����Ȼ���ķе�ͣ���Eװ���б�ˮ�������ǿ�����ȴSiCl4��������6�����Ȼ�����ˮ��Ӧ����װ��ӦΪ��ˮ��������Ӧ�е�������Ⱦ������Ӧ���գ���F�м�ʯ�ҵ����������ն��������ͷ�ֹ�����е�ˮ��������hװ�������Ȼ��跴Ӧ��