题目内容
【题目】Ⅰ、海水是可以综合利用的。从海水中提取食盐和溴的过程:

(1)请写出一种海水淡化的方法________________________。
(2)步骤Ⅰ获取Br2的离子方程式为_________________________________________________。
(3)步骤Ⅱ用SO2水溶液吸收Br2,使溴蒸气转化为氢溴酸以达到富集的目的。其反应的化学方程式为Br2+SO2+2H2O=H2SO4+2HBr,在该反应中,还原剂是________(填化学式)。
Ⅱ、海带中的碘元素主要以I-的形式存在,提取时用适当的氧化剂将其氧化成I2,再萃取出来。证明海带中含有碘的实验步骤:
①用剪刀剪碎海带,用酒精湿润,放入坩埚中。
②灼烧海带至完全成灰,停止加热,冷却。
③将海带灰加蒸馏水溶解,搅拌、煮沸、过滤。
④在滤液中滴加稀硫酸及过氧化氢,然后加入几滴淀粉溶液,(涉及反应的离子方程式为2I-+H2O2+2H+=I2+2H2O)。
能证明海带中含有碘的实验步骤是________(填序号),现象是_________________________。
【答案】蒸馏法 Cl2+2Br-===Br2+2Cl- SO2 ④ 滴入淀粉溶液后变蓝
【解析】
通过海水蒸发得到淡水、NaCl、母液,向母液中通入氯气,发生反应Cl2+2Br-===Br2+2Cl-,利用热空气吹出溴,用SO2吸收Br2,发生反应SO2+Br2+2H2O=H2SO4+2HBr,向溶液中通入氯气发生反应Cl2+2Br-===Br2+2Cl-,然后采用萃取的方法获取Br2,以此解答该题。
(1)淡化海水的方法有:蒸馏法、电渗析法、离子交换法等;
(2)氯气具有氧化性,能氧化溴离子生成单质溴:Cl2+2Br-===Br2+2Cl-;
(3)化学方程式为Br2+SO2+2H2O=H2SO4+2HBr,因Br2中Br的化合价从0价降低为1价,Br2是氧化剂,S元素化合价升高,SO2为还原剂
Ⅱ、能证明海带中含有碘的实验操作是第④步,碘离子在酸性条件下,被双氧水氧化成碘单质,取少量第④步的溶液,滴加几滴淀粉溶液,观察到的现象是溶液变蓝。

 阅读快车系列答案
阅读快车系列答案【题目】![]() 是一种饲料营养强化剂。一种利用水钴矿(主要成分为
是一种饲料营养强化剂。一种利用水钴矿(主要成分为![]() 、
、![]() ,还含少量
,还含少量![]() 、
、![]() 、MnO等),制取
、MnO等),制取![]() 的工艺流程如图1:
的工艺流程如图1:
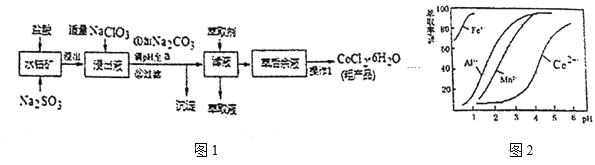
已知:①浸出液含有的阳离子主要有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等;
等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:(金属离子浓度为:0.01mol/L)
③![]() 熔点为86℃,加热至110~120℃时,失去结晶水生成无水氧化钴。
熔点为86℃,加热至110~120℃时,失去结晶水生成无水氧化钴。
沉淀物 |
|
|
|
|
|
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中![]() 发生反应的离子方程式____。
发生反应的离子方程式____。
(2)写出NaClO3发生反应的主要离子方程式____,若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式____。
(3)“加![]() 调pH至a”,过滤所得到的沉淀成分为___。
调pH至a”,过滤所得到的沉淀成分为___。
(4)制得的![]() 在烘干时需减压烘干的源因是___。
在烘干时需减压烘干的源因是___。
(5)萃取剂对金属高子的萃取率与pH的关系如图2。向“滤液”中加入萃取剂的目的是___﹔其使用的最佳pH范围是___。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5






