题目内容
【题目】常温下,向 20 mL 0.1 mol·L-1 的 CH3COOH 溶液中不断滴入 0.1 mol·L-1 的 NaOH溶液,溶液的pH变化曲线,如图所示。在滴定过程中,关于溶液中离子浓度大小关系的描述错误的是
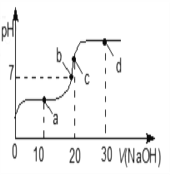
A. a 点时: c( CH3COO-)>c( Na+)>c( H+)>c( OH-)
B. b 点时:c( Na+) =c( CH3COO-)>c(H+)=c( OH-)
C. c 点时:c(OH-)=c(CH3COOH) +c(H+)
D. d 点时:c(Na+)> c(OH-) > c(CH3COO-) >c(H+)
【答案】D
【解析】A、a 点时相当于CH3COOH与CH3COONa等物质的量混和,溶液呈酸性,说明CH3COOH电离大于CH3COO-水解,c( CH3COO-)>c( Na+),则c( CH3COO-)>c( Na+)>c( H+)>c( OH-),选项A正确;B、b 点时溶液呈中性,c(H+)=c( OH-)=10-7mol/L,根据电荷守恒有:c( Na+) +c(H+)=c( CH3COO-)+c( OH-),且溶质主要为醋酸钠,故有c( Na+) =c( CH3COO-)>c(H+)=c( OH-),选项B正确;C、c 点时完全中和,电荷守恒为:c( Na+) +c(H+)=c( CH3COO-)+c( OH-),物料守恒为:c( Na+)= c( CH3COO-)+c(CH3COOH),将后等式代入前等式可得:c(OH-)=c(CH3COOH) +c(H+),选项C正确;D、d 点时为醋酸钠和氢氧化钠的物质的量之比为2:1的溶液,故: c(CH3COO-)> c(OH-),选项D错误。答案选D。

 名校课堂系列答案
名校课堂系列答案【题目】已知FeSO4在不同条件下分解得到的产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2。某研究小组探究在酒精喷灯加热条件下FeSO4分解的气体产物。已知SO3的熔点是16.8 ℃,沸点是44.8 ℃。

(1)装置Ⅱ的试管中不装任何试剂,其作用是______________________________,试管浸泡在50 ℃的水浴中,目的是___________________。
(2)装置Ⅲ和装置Ⅳ的作用是探究本实验气体产物成分。请完成实验设计,填写检验试剂、预期现象与结论。
限选试剂:A.3 mol·L-1H2SO4、B.6 mol·L-1NaOH、C.0.5 mol·L-1BaCl2、D.0.5 mol·L-1Ba(NO3)2、E.0.01 mol·L-1酸性KMnO4溶液。(填所选试剂的序号)
检验试剂 | 预期现象和结论 |
装置Ⅲ的试管中加入________ | 产生大量白色沉淀,证明气体产物中含有SO3 |
装置Ⅳ的试管中加入________ | ____________________ |
(3)装置Ⅴ的作用是防止尾气污染环境,烧杯中应加入的试剂是________。
(4) 配平离子方程式,并在![]() 中填上所需的微粒:_______________________
中填上所需的微粒:_______________________
H++ MnO4-+ Fe2+→ Mn2+ Fe3++ ![]()