题目内容
【题目】洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)实验室制氯气的化学方程式:________________________,此反应的氧化剂为:_____________ ;还原剂为:_____________;氧化剂与还原剂物质的量之比为:______________;
(2)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,写出化学反应方程式,并画出双线桥,标出电子转移的方向和数目:__________________________________。
(3)漂白粉的有效成分是________________________(填化学式)。
【答案】MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O MnO2 HCl 1:2
MnCl2+Cl2↑+2H2O MnO2 HCl 1:2 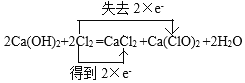 Ca(ClO)2
Ca(ClO)2
【解析】
(1)在实验室中用二氧化锰与浓盐酸混合加热制氯气,据此书写化学方程式,根据氧化还原反应的概念、关系判断和计算;
(2)氯气与石灰乳反应产生氯化钙、次氯酸钙和水,根据化合价升降总数相等,等于反应过程中电子转移数目,用双线桥法表示电子转移;
(3)漂白粉的有效成分是次氯酸钙。
(1)在实验室中用二氧化锰与浓盐酸混合加热制氯气,反应的化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。在该反应中Mn元素的化合价由反应前MnO2中的+4价变为反应后MnCl2中的+2价,化合价降低,获得电子,所以MnO2为氧化剂;Cl元素的化合价由反应前HCl中的-1价变为反应后Cl2中的0价,化合价升高,失去电子,所以HCl为还原剂;在反应方程式中4个HCl参加反应,只有2个失去电子变为氯气,所以氧化剂与还原性的物质的量的比为1:2;
MnCl2+Cl2↑+2H2O。在该反应中Mn元素的化合价由反应前MnO2中的+4价变为反应后MnCl2中的+2价,化合价降低,获得电子,所以MnO2为氧化剂;Cl元素的化合价由反应前HCl中的-1价变为反应后Cl2中的0价,化合价升高,失去电子,所以HCl为还原剂;在反应方程式中4个HCl参加反应,只有2个失去电子变为氯气,所以氧化剂与还原性的物质的量的比为1:2;
(2)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,该反应的化学反应方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,在该反应中,只有Cl元素的化合价发生变化,2个Cl2中,有2个Cl原子失去电子,变为Ca(ClO)2,有2个Cl原子获得电子,变为CaCl2,用双线桥法表示电子转移为: 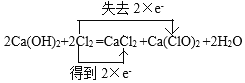 ;
;
(3)漂白粉的成分是CaCl2和Ca(ClO)2,有效成分是Ca(ClO)2。



