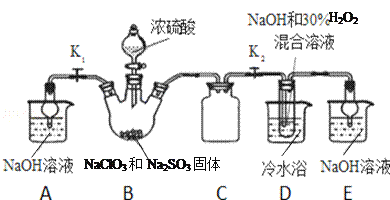
��Ŀ����
����Ŀ����֪��Ӧ��C2H5OH+NaBr+H2SO4(Ũ) ![]() NaHSO4+C2H5Br+H2O��ʵ��������ͼ��ʾװ���Ʊ�������(�е�Ϊ38.4 �棬�ܶ�Ϊ1.43 g��mL-l)��
NaHSO4+C2H5Br+H2O��ʵ��������ͼ��ʾװ���Ʊ�������(�е�Ϊ38.4 �棬�ܶ�Ϊ1.43 g��mL-l)��

ʵ��ǰ��������a �м���10 g �Ҵ�������Ũ���ᣬȻ�������ϸ��20.6g �廯�ƺͼ������Ƭ�����Թ�d�м�����������ˮ��
�ش��������⣺
��1���������Ƭ��������__________________________��
��2��Ϊ�˸��õĿ��Ʒ�Ӧ�¶ȣ�����ͼʾ�ļ��ȷ����⣬���õļ��ȷ�����_______________________��
��3���Թ�d �г��ֵ�ʵ��������__________________________��
��4����Ӧ�������Թ�d�к���������Br2��Ϊ�˳�ȥ�ֲ�Ʒ�е�����Br2����ѡ�õ��Լ���________(����ĸ)
A.�� B.H2O C.Na2SO3��Һ D.CCl4
��5���������롢�ᴿ�������ʵ�����յõ�8.7g�����飬��ʵ��������IJ���Ϊ__________��
��6��ͨ�����¼���ʵ�鲽��ɼ����������е���Ԫ�أ�����ȷ�IJ���˳����ȡ���������飬__________������ţ���
�ټ��� �ڼ���AgNO3��Һ �ۼ���ϡHNO3�ữ �ܼ���NaOH��Һ ����ȴ
���𰸡� ��ֹҺ�屩�� ˮԡ���� Һ��ֲ㣬�²�Ϊ��״Һ�� C 40% �ܢ٢ݢۢ�
����������1����ͼװ����Ҫ�þƾ��ƶ�װ��a�������������Ƭ����Ӵ��������ֹҺ����ֲ����ȶ����У��ʴ�Ϊ����ֹҺ�屩����
��2������������ķе���38.4�棬����Ϊ�˸��õĿ��Ʒ�Ӧ�¶ȣ�����ͼʾ��С����ȣ����õļ��ȷ�ʽ��ˮԡ���ȡ�
��3��������ķе�ͣ������ڱ�ˮ����ȴ������̬���Һ̬�����Թ�d�пɹ۲쵽Һ��ֲ㣬�²�Ϊ��״Һ����
��4�����ɵ��������к���������Br2����Br2����ǿ�����ԣ�����Ϊ�˳�ȥ�ֲ�Ʒ�е�����Br2��Ӧѡ����л�ԭ�Ե�����������Һ����ѡC��
��5��20.6g�廯�Ƶ����ʵ���Ϊ��20.6g��103g/mol=0.2mol��10g�Ҵ������ʵ���Ϊ��10g��46g/mol>0.2mol�����ݻ�ѧ����ʽ�ɵ��廯�ƺ��Ҵ������������ʵ���֮��Ϊ1��1��1����������������۲���Ϊ��0.2mol��109g/mol=21.8g����Ϊ��ʵ�����յõ�8.7g�����飬��ʵ��������IJ���Ϊ��8.7g��21.8g��100%��40%��
��6��Ҫ��������������Ԫ�أ�����ʹ���������������Ƶ�ˮ��Һ��ˮ�⣬Ȼ���ټ��������к��������ƣ���������������Һ��������ȷ�IJ���˳���Ǣܢ٢ݢۢڡ�