题目内容
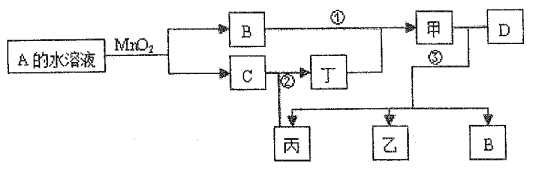
【题目】将羧酸的碱金属盐溶液用惰性电极电解可得到烃类化合物,例如:2CH3COOK+2H2O ![]() CH3CH3↑+2CO2↑+H2↑+2KOH现有下列衍变关系(A、B、C、D、E、F、G均为有机物): 回答下列问题:
CH3CH3↑+2CO2↑+H2↑+2KOH现有下列衍变关系(A、B、C、D、E、F、G均为有机物): 回答下列问题:
(1)电解ClCH2COOK溶液时阳极的电极反应式是(填选项).
A.2ClCH2COO﹣﹣2e﹣=ClCH2CH2Cl+2CO2↑
B.2H++2e﹣=H2↑
C.2H2O+2e﹣=2OH﹣+H2↑
D.4OH﹣﹣4e﹣=2H2O+O2↑
(2)操作Ⅰ的名称是 , G的结构简式是 .
(3)写出B与银氨溶液按物质的量1:4反应的化学方程式: .
(4)写出下列化学方程式并指出其反应类型:A→B方程式: .
E→F方程式: .
指出反应类型:A→B , E→F .
【答案】
(1)A
(2)分液;![]()
(3)![]()
(4)HOCH2CH2OH+O2 ![]() OHC﹣CHO+2H2O;ClCH2CH2Cl+KOH→CH2=CHCl+KCl+H2O;氧化反应;消去反应
OHC﹣CHO+2H2O;ClCH2CH2Cl+KOH→CH2=CHCl+KCl+H2O;氧化反应;消去反应
【解析】解:由题目信息可知,电解ClCH3COOK溶液得到ClCH2CH2Cl、KOH混合溶液,加热ClCH2CH2Cl发生水解得到A为HOCH2CH2OH,乙二醇发生催化氧化生成B为OHC﹣CHO,乙二醛与银氨溶液发生氧化反应C为HOOC﹣COOH,乙二酸与乙二醇发生酯化反应生成D,ClCH2CH2Cl不溶于水,静置,分液得到Y为KOH,E为ClCH2CH2Cl,E在KOH、乙醇、加热条件下发生消去反应生成F,F发生加聚反应生成含氯高分子,则F为CH2=CHCl,G为 ![]() ,(1)电解ClCH2COOK溶液时,阳极发生氧化反应,ClCH2COO﹣在阳极放电生成ClCH2CH2Cl、CO2 , 阳极电极反应式为:2ClCH2COO﹣﹣2e﹣=ClCH2CH2Cl+2CO2↑,故选:A;(2)ClCH2CH2Cl不溶于水,静置,分液得到Y为KOH,E为ClCH2CH2Cl,G的结构简式是
,(1)电解ClCH2COOK溶液时,阳极发生氧化反应,ClCH2COO﹣在阳极放电生成ClCH2CH2Cl、CO2 , 阳极电极反应式为:2ClCH2COO﹣﹣2e﹣=ClCH2CH2Cl+2CO2↑,故选:A;(2)ClCH2CH2Cl不溶于水,静置,分液得到Y为KOH,E为ClCH2CH2Cl,G的结构简式是 ![]() ,所以答案是:分液;
,所以答案是:分液; ![]() ;(3)B为OHC﹣CHO,与银氨溶液按物质的量1:4反应生成C的化学方程式:
;(3)B为OHC﹣CHO,与银氨溶液按物质的量1:4反应生成C的化学方程式: ![]() , 所以答案是:
, 所以答案是: ![]() ;(4)A是HOCH2CH2OH,B是OHC﹣CHO,A→B是醇的催化氧化生成醛,所以方程式为:HOCH2CH2OH+O2
;(4)A是HOCH2CH2OH,B是OHC﹣CHO,A→B是醇的催化氧化生成醛,所以方程式为:HOCH2CH2OH+O2 ![]() OHC﹣CHO+2H2O,E是ClCH2CH2Cl,而F是CH2=CHCl,E→F是由饱和到不饱和,发生消去反应,方程式为:ClCH2CH2Cl+KOH→CH2=CHCl+KCl+H2O;A→B:氧化反应;E→F:消去反应;所以答案是:HOCH2CH2OH+O2
OHC﹣CHO+2H2O,E是ClCH2CH2Cl,而F是CH2=CHCl,E→F是由饱和到不饱和,发生消去反应,方程式为:ClCH2CH2Cl+KOH→CH2=CHCl+KCl+H2O;A→B:氧化反应;E→F:消去反应;所以答案是:HOCH2CH2OH+O2 ![]() OHC﹣CHO+2H2O;ClCH2CH2Cl+KOH→CH2=CHCl+KCl+H2O;氧化反应;消去反应.
OHC﹣CHO+2H2O;ClCH2CH2Cl+KOH→CH2=CHCl+KCl+H2O;氧化反应;消去反应.

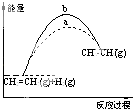
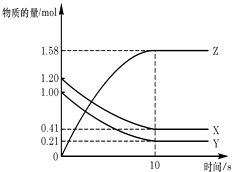
【题目】苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是C8H10(g)C8H8(g)+H2(g)△H>0 Ⅰ.某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内物质的量,得到数据如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2[来源:] | n3 |
n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
(1)当反应进行到20min时,该段时间内H2的平均反应速率是 .
(2)该温度下,该反应的化学平衡常数是 .
化学键 | C﹣H | C﹣C | C=C | H﹣H |
键能/kJmol1 | 412.5 | 348 | 612 | 436 |
(3)已知: 计算上述反应的△H=kJmol﹣1 . 若保持其他条件不变,用0.40mol H2(g)和0.40mol C8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是 . 此时,该反应是否达到了平衡状态?(填“是”或“否”).
Ⅱ.工业上以高温水蒸气作为反应体系的稀释剂(不参与反应),C8H10(g)的平衡转化率与水蒸气的用量、体系的温度、压强的关系如图Ⅰ、图Ⅱ所示.
(4)由图Ⅰ可知,T1T2(填“大于”、“小于”或“等于”).
(5)由图Ⅱ可知,当其他条件不变时,水蒸气的用量越大,C8H10的平衡转化率将(填“越大”、“越小”或“不变”),原因是 .
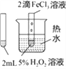
【题目】下列图中的实验方案,能达到实验目的的是:( )
A | B | C | D | |
实验方案 |
|
|
|
|
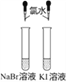
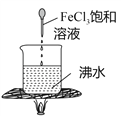
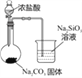
实验目的 | 验证FeCl3对H2O2分解反应有催化作用 | 验证单质氧化性: Cl2>Br2>I2 | 加热至混合液呈红褐色,停止加热,制备Fe(OH)3胶体 | 比较HCl、H2CO3和H2SiO3的酸性强弱 |
A. A B. B C. C D. D