题目内容
【题目】一定条件下,下列氧化还原反应中,氧化剂与还原剂的物质的量之比不为1:2的是
A.3NO2+H2O=2HNO3+NO
B.I2+2NaClO3=2NaIO3+Cl2
C.SiO2+3C=SiC+2CO↑
D.MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
【答案】B
【解析】
试题分析:A.反应3NO2+H2O=2HNO3+NO中氧化剂与还原剂的物质的量之比为1:2,故不选A;B.反应I2+2NaClO3=2NaIO3+Cl2中氧化剂与还原剂的物质的量之比为2:1,故答案选B;C.反应SiO2+3C=SiC+2CO↑中氧化剂与还原剂的物质的量之比为1:2,故不选C;D.反应MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O中氧化剂与还原剂的物质的量之比为1:2,故不选D;答案为B。
MnCl2+Cl2↑+2H2O中氧化剂与还原剂的物质的量之比为1:2,故不选D;答案为B。

【题目】[选修3:物质结构与性质]
根据元素周期表中第四周期元素的相关知识,回答下列问题:
(1)第四周期元素的基态原子的电子排布中4s轨道上只有1个电子的元素有____________种;写出Cu+的核外电子排布式____________。
(2)按电子排布,可将周期表里的元素划分成五个区域,第四周期元素中属于s区的元素有_________种,属于d区的元素有____________种。
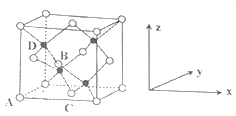
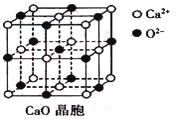
(3)CaO晶胞如下图所示,CaO晶体中Ca2+的配位数为____________;
(4)由叠氮化钾(KN3)热分解可得纯N2:2KN3(s)=2K(l)+3N2(g),下列有关说法正确的是________(填选项字母)。
A.NaN3与KN3结构类似,前者晶格能较小 |
B.晶体钾的晶胞结构如图所示: |
C.氮的第一电离能大于氧 |
D.氮气常温下很稳定,是因为氮的电负性小 |
(5)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂。O2在其催化作用下,可将CN-氧化成CNO-。CN-的电子式为___________,CNO-的中心原子的杂化方式为___________。
(6)在CrCl3溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
[CrCln(H2O)6-n]x++xR-H→Rx[CrCln(H2O)6-n]+xH+。
将含0.0015mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol/LNaOH溶液25.00 mL,则该配离子的化学式为_____________________。