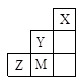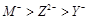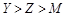题目内容
元素周期表中同周期或同主族元素,随着原子序数的递增,下列说法正确的是
| A.ⅦA族元素的单质沸点逐渐降低 |
| B.ⅥA族元素的原子核外最外层电子数逐渐增多 |
| C.碱金属元素最高价氧化物的水化物碱性逐渐增强 |
| D.第二周期元素(除稀有气体元素)的最高化合价数值逐渐增大 |
C
试题分析:同一主族金属的单质的熔沸点由上至下依次降低,如IA族的金属元素,IIA族所有元素同一主族非金属的单质的熔沸点由上至下依次升高,如VIIA族的卤族元素,VIA族氧族元素VA族元素先是非金属,后是金属,先降后升,A选项不正确,同一主族元素的原子核外最外层电子数相同,B选项不正确,同主族自上而下金属性逐渐增强,非金属性逐渐强弱,所以最高价氧化物的水化物碱性逐渐增强,C选项正确,第二周期中氧氟无最高正价,D选项不正确。

练习册系列答案
相关题目