题目内容
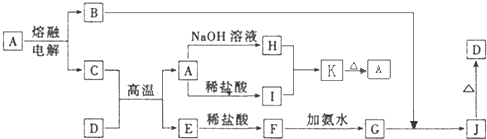
A-J是中学化学常见的物质,它们之间的转化关系如图甲所示(部分产物已略去).已知A是一种高熔点物质,D是一种红棕色固体.
请回答下列问题:
(1)A物质的名称为
(2)C与D在高温下的反应在冶金工业上称为
(3)写出G→J的化学方程式:
(4)C的氮化物是一种良好的耐热冲击材料,可溶解于强碱溶液,写出其反应方程式:
(5)E在潮湿的空气中容易被腐蚀,为了减少腐蚀,可以采用电化学的方法进行防护装置如图乙所示:
当开关K置于M处,E电极材料应为
当开关K置于N处、E为碳棒时,N与电源的
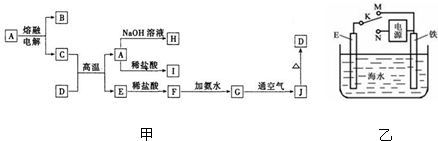
请回答下列问题:
(1)A物质的名称为
氧化铝
氧化铝
,H与I反应所得难溶物化学式为Al(OH)3
Al(OH)3
.(2)C与D在高温下的反应在冶金工业上称为
铝热
铝热
反应(3)写出G→J的化学方程式:
4Fe(OH)2+O2+2H2O=4Fe(OH)3
4Fe(OH)2+O2+2H2O=4Fe(OH)3
(4)C的氮化物是一种良好的耐热冲击材料,可溶解于强碱溶液,写出其反应方程式:
AlN+NaOH+H2O=NaAlO2+NH3↑
AlN+NaOH+H2O=NaAlO2+NH3↑
.(5)E在潮湿的空气中容易被腐蚀,为了减少腐蚀,可以采用电化学的方法进行防护装置如图乙所示:
当开关K置于M处,E电极材料应为
锌
锌
;当开关K置于N处、E为碳棒时,N与电源的
正
正
极连接.
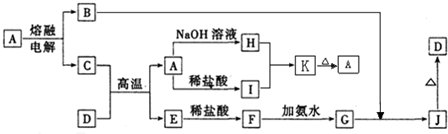
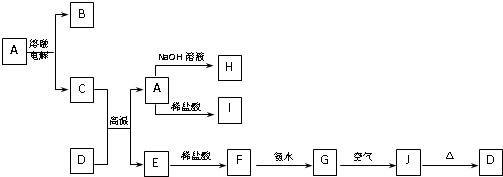
分析:A是一种高熔点物质,可在高温下电解,应为氧化铝,则B为O2,D是一种红棕色固体,应为Fe2O3,与Al发生铝热反应,则E为Fe,根据反应关系可知H为NaAlO2,I为AlCl3,F为FeCl2,G为Fe(OH)2,J为Fe(OH)3,铁的防护有牺牲阳极的阴极保护法和外加电源的阴极保护法.
解答:解:A是一种高熔点物质,可在高温下电解,应为氧化铝,则B为O2,D是一种红棕色固体,应为Fe2O3,与Al发生铝热反应,则E为Fe,根据反应关系可知H为NaAlO2,I为AlCl3,F为FeCl2,G为Fe(OH)2,J为Fe(OH)3,
(1)由以上分析可知A为氧化铝,H为NaAlO2,I为AlCl3,二者可发生互促水解生成Al(OH)3,故答案为:氧化铝;Al(OH)3;
(2)Fe2O3与Al发生铝热反应,为工业常见反应,故答案为:铝热;
(3)G为Fe(OH)2,J为Fe(OH)3,反应的方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)C的氮化物为AlN,与NaOH反应的方程式为AlN+NaOH+H2O=NaAlO2+NH3↑,故答案为:AlN+NaOH+H2O=NaAlO2+NH3↑;
(5)当开关K置于M处,为防止Fe腐蚀,形成原电池反应时,Fe为正极,Zn为负极,当开关K置于N处、E为碳棒时,N与电源的正极连接,铁与电源负极连接,为外加电源的阴极保护法,故答案:锌;正.
(1)由以上分析可知A为氧化铝,H为NaAlO2,I为AlCl3,二者可发生互促水解生成Al(OH)3,故答案为:氧化铝;Al(OH)3;
(2)Fe2O3与Al发生铝热反应,为工业常见反应,故答案为:铝热;
(3)G为Fe(OH)2,J为Fe(OH)3,反应的方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)C的氮化物为AlN,与NaOH反应的方程式为AlN+NaOH+H2O=NaAlO2+NH3↑,故答案为:AlN+NaOH+H2O=NaAlO2+NH3↑;
(5)当开关K置于M处,为防止Fe腐蚀,形成原电池反应时,Fe为正极,Zn为负极,当开关K置于N处、E为碳棒时,N与电源的正极连接,铁与电源负极连接,为外加电源的阴极保护法,故答案:锌;正.
点评:本题考查无机物的推断,题目难度中等,本题注意根据物质反应的条件以及物质的颜色,为推断该题的突破口,明确物质的种类为解答该题的关键,易错点为(4),注意题给信息.

练习册系列答案
相关题目
 Fe(OH)3+3H+
Fe(OH)3+3H+