题目内容
一定条件下,在体积为10 L的密闭容器中,1 mol A和1 mol B进行反应:2A(g)+B(g) 2C(g),达到平衡时生成0.6 mol C。下列说法正确的是
2C(g),达到平衡时生成0.6 mol C。下列说法正确的是
A.当容器内密度保持不变时,可以判断反应已达平衡
B.其他条件不变,将容器体积变为5 L,C的平衡浓度变为原来的2倍
C.其他条件不变,若增大压强,则物质A的转化率减小
D.达到平衡时,C的体积百分含量为0.353
D
解析试题分析:A.容器内密度无论是在平衡前还是平衡后均保持不变故无法判断反应是否已达平衡,错误。B.其他条件不变,将容器体积变为5 L,相当于增加了压强,平衡右移,此时C的平衡浓度变为超过原来的2倍,错误。C.其他条件不变,若增大压强,平衡右移,则物质A的转化率增大,错误。D.运用三段法进行计算,达到平衡时,C的体积百分含量为0.353,正确。
考点:本题考查化学平衡的移动和转化率的判断。

 名校课堂系列答案
名校课堂系列答案某恒温密闭容器发生可逆反应:Z(?)+W(?) X(g)+Y(?) ΔH,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是
X(g)+Y(?) ΔH,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是
| A.Z和W在该条件下至少有一个是为气态 |
| B.t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量可能相等也可能不等 |
| C.若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度不相等 |
| D.若该反应只在某温度T以上自发进行,则该反应的平衡常数K随温度升高而减小 |
T℃时在2L刚性密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为Tl和T2时,Y的体积分数 (Y)与时间的关系如图2所示。则下列结论错误的是
(Y)与时间的关系如图2所示。则下列结论错误的是
A.容器中发生的反应可表示为:3X(g)+Y(g) 2Z(g) 2Z(g) |
| B.反应进行的前4min内,用X表示的反应速率v(X)=0.15mo1?(L?min)—1 |
| C.保持其他条件不变,升高温度,反应的化学平衡常数K减小 |
| D.若改变反应条件,使反应进程如图3所示,则改变的条件是使用催化剂 |
在容积一定的密闭容器中发生可逆反应:A(g)+2B(g) 2C(g) ΔH>0,其他条件不变化,只有温度变化时,某量随温度变化的关系如图所示。则下列说法中,正确的是
2C(g) ΔH>0,其他条件不变化,只有温度变化时,某量随温度变化的关系如图所示。则下列说法中,正确的是
| A.若P1>P2,纵坐标表示A的质量分数 |
| B.若P1<P2,纵坐标表示C的质量分数 |
| C.若P1>P2,纵坐标表示混合气体的平均摩尔质量 |
| D.若P1<P2,纵坐标表示A的转化率 |
重铬酸钾溶液中存在如下平衡:Cr2O72-(橙红色)+H2O  2H++2CrO42-(黄色),向K2Cr2O7溶液中加入下列哪种试剂,溶液颜色会从黄色逐渐变为橙红色
2H++2CrO42-(黄色),向K2Cr2O7溶液中加入下列哪种试剂,溶液颜色会从黄色逐渐变为橙红色
| A.NaHSO4 | B.NaHCO3 | C.Na2CO3 | D.CH3COONa |
在密闭容器中存在下列平衡:CO(g)+H2O(g)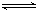 CO2(g)+H2(g),CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是
CO2(g)+H2(g),CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是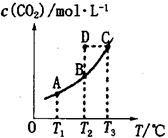
| A.平衡状态A与C相比,平衡状态A的c(CO)小 |
| B.在T2时,若反应处于状态D,则一定有v正<v逆 |
C.反应CO(g)+H2O(g) CO2(g)+H2(g)△H>0 CO2(g)+H2(g)△H>0 |
| D.若T1、T2时的平衡常数分别为K1、K2,则K1<K2 |
在一个绝热的密闭反应器中,只发生两个反应:
a(g)+b(g)  2c(g);ΔH1<0
2c(g);ΔH1<0
x(g)+3y(g)  2z(g);ΔH2>0
2z(g);ΔH2>0
进行相关操作且达到平衡后(忽略体积改变所作的功),下列叙述错误的是
| A.等容时,通入惰性气体,各反应速率不变 |
| B.等容时,通入z气体,y的物质的量浓度增大 |
| C.等压时,通入z气体,反应器中温度升高 |
| D.等压时,通入惰性气体,c的物质的量不变 |
 2C(气);△H<0 ,经 2 s(秒)后测得 C 的浓度为0.6 mol·L-1 ,现有下列几种说法:
2C(气);△H<0 ,经 2 s(秒)后测得 C 的浓度为0.6 mol·L-1 ,现有下列几种说法: 3C+4D反应中,表示该反应速率最快的是
3C+4D反应中,表示该反应速率最快的是