题目内容
(11分)(1)为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
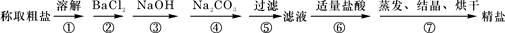
①第5步实验操作需要烧杯、____________、___________玻璃仪器。
②步骤2中,判断加入BaCl2已过量的方法是:
。
③除杂试剂BaCl2、NaOH、Na2CO3加入的顺序必须满足 。
④若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是_____________________________。
(2)为检验粗盐溶液中Cl-、SO42-请根据内容填空:
①首先检验 离子,应先加入过量的 。
②将所得混合物过滤,然后在溶液中加入试剂 检验另一离子。
(11分)(1)①玻璃棒 漏斗
②在2步骤后的上层清液中,再滴入BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量(其它合理答案也可) (2分) ③Na2CO3 在BaCl2后 (2分)④使部分沉淀溶解(2分)
(2)①SO42-, Ba(NO3)(HNO3) ② AgNO3(HNO3)
【解析】(1)①过滤需要烧杯、玻璃棒和漏斗。
②判断加入BaCl2已过量的方法是继续加入氯化钡,即在2步骤后的上层清液中,再滴入BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量。
③由于过量的氯化钡必需通过碳酸钠来除去,所以顺序必需是Na2CO3 在BaCl2后面。
④由于盐酸钠溶解沉淀碳酸钡、碳酸钙和氢氧化镁,所以又引入杂质。
(2)①由于硫酸银也是难溶性的白色沉淀,所以首先检验SO42-, 所用试剂是硝酸酸化的硝酸钡。
②检验氯离子用硝酸酸化的硝酸银。

 阅读快车系列答案
阅读快车系列答案
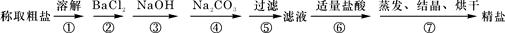
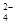 ,得到纯净的NaCl晶体,需加入以下试剂:A.过量的NaOH溶液;B.过量的Na2CO3溶液;C.适量的盐酸;D.过量的BaCl2溶液。
,得到纯净的NaCl晶体,需加入以下试剂:A.过量的NaOH溶液;B.过量的Na2CO3溶液;C.适量的盐酸;D.过量的BaCl2溶液。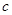 (OH-)的比值是_________。
(OH-)的比值是_________。