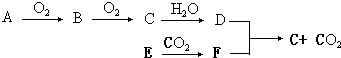题目内容
【题目】已知A是生产生活中用量最大的金属,B为淡黄色粉末。在常温下C为无色液体,E、G、H、I、J为气体,其中H为黄绿色,其它为无色.J能使湿润的红色石蕊试纸变蓝(图中部分产物已略去)。
请填写下列空白
(1)写出化学式:M , K。
(2)写出①的化学方程式;写出③的离子方程式。
(3)反应④属于下列何种反应类型______(填字母序号)。
A.化合反应
B.氧化还原反应
C.离子反应
D.置换反应
(4)若要确定③反应后所得溶液中含有M物质,所选试剂为______(填序号)。
A.KSCN溶液和氯水
B.铁粉和KSCN
C.浓氨水
D.酸性高锰酸钾溶液
(5)常温下,H与过量的J反应产生浓厚的白烟,另一生成物是空气的主要成分之一,请写出该反应的化学方程式。
【答案】
(1)FeCl2;NH4Cl
(2)3Fe+4H2O ![]() Fe3O4+4H2;Fe3O4+8H+=Fe2++2Fe3++4H2O
Fe3O4+4H2;Fe3O4+8H+=Fe2++2Fe3++4H2O
(3)A,B,C
(4)D
(5)8NH3+3Cl2= 6NH4Cl+ N2
【解析】由题中所给信息,A是金属铁,常温下C为无色液体只能是水,A能和水蒸气反应生成D(四氧化三铁)和E(氢气)。H为黄绿色,所以H是氯气,I是氯化氢。又有J能使湿润的红色石蕊试纸变蓝也是解本题的突破口,可得J为氨气,所以K为NH4Cl。B为淡黄色粉末,可能是单质硫、过氧化钠、溴化银等,依据转化关系可知B只能是过氧化钠,其和水反应生成G(氧气)和F(氢氧化钠),F(氢氧化钠)和K(NH4Cl)反应生成无色气体J(氨气),
(1)由以上分析可知M为FeCl2 , K为NH4Cl;
(2)反应①是铁与水蒸汽反应生成四氧化三铁和氢气,其化学方程式为3Fe+4H2O ![]() Fe3O4+4H2 ;反应③是四氧化铁溶解于稀盐酸生成氯化铁和氯化亚铁的溶解,反应的离子方程式为Fe3O4+8H+=Fe2++2Fe3++4H2O;
Fe3O4+4H2 ;反应③是四氧化铁溶解于稀盐酸生成氯化铁和氯化亚铁的溶解,反应的离子方程式为Fe3O4+8H+=Fe2++2Fe3++4H2O;
(3)反应④为2Fe2++Cl2=2Fe3++2Cl- , 该反应为化合反应、氧化还原反应、离子反应,所以答案是ABC;
(4)③反应后所得溶液中含有Fe2+ , 可与酸性高锰酸钾溶液发生氧化还原反应而使高锰酸钾溶液褪色,其它选项不能证明,不能排除铁离子的干扰,所以答案是D;
(5)常温下,H与过量的J反应产生浓厚的白烟,另一生成物是空气的主要成分之一,该反应的方程式为8NH3+3Cl2=N2+6NH4Cl。