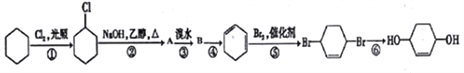
题目内容
【题目】利用反应6NO2+8NH3===7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减少环境污染,又能充分利用化学能,装置如图所示。下列说法正确的是
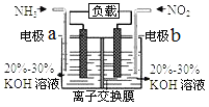
A.电流从电极a经负载后流向电极b
B.为使电池持续放电,离子交换膜只允许阴离子通过
C.a电极的电极反应式为:2NH36e===N2+6H+
D.室温下,当有4.48 L NO2被处理时,转移电子数为0.8 mol
【答案】B
【解析】
试题分析:由反应6NO2+8NH3===7N2+12H2O可知,NH3失电子发生氧化反应,NO2得电子发生还原反应,则a 为负极,b为正极。A.a 为负极,b为正极,电流由正极经负载流向负极,A错误;B.正极的电极反应为2NO2+8e+4H2O===N2+8OH,生成的OH会使正极区碱性增强,为使电池持续放电,需OH通过半透膜进入负极区并参与电极反应,所以应选择阴离子交换膜只允许阴离子通过,B正确;C.电解质溶液为碱性的KOH溶液,则负极的电极反应式为2NH36e+6OH===N2+6H2O,C错误;D.从化学方程式可知,当有0.2 mol NO2被处理时,转移电子数为![]() =0.8 mol,但室温下,4.48 L NO2的物质的量不等于0.2 mol,D错误。
=0.8 mol,但室温下,4.48 L NO2的物质的量不等于0.2 mol,D错误。

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目