题目内容
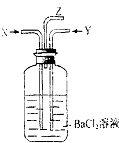
【题目】实验室用乙醇与氢溴酸反应合成溴乙烷,其装置如下(夹持和加热装置略): 
【查阅资料】NaBr+H2SO4=NaHSO4+HBr
溴乙烷是无色液体,沸点38.4℃,密度1.44g/cm3 .
【合成反应】在a中加入20mL 95%的乙醇和20mL水,在搅拌、冷却下,缓慢加入40mL浓硫酸.再加入30g溴化钠和几粒碎瓷片,d中加入少量冰水并置于冰水浴e中.b中通入冷却水后,小火加热a,直到c处无油滴滴出,结束反应.
【分离提纯】将d中馏出液转入分液漏斗中,静置,将有机层转入另一锥形瓶并置于冰水浴中冷却;在振荡下向有机液中逐滴加入4mL浓硫酸,再用干燥的分液漏斗分去硫酸层.最后通过蒸馏得到纯净的溴乙烷.
请回答下列问题:
(1)冷凝管的进水口是(填字母编号).
(2)a中加入碎瓷片的作用是 . 锥形瓶置于冰水浴中冷却降温的原因是 . 如果d中的馏出液略带橙红色,其中橙红色的物质可用足量饱和NaHSO3溶液洗涤除去,有关反应的离子方程式是 .
(3)本实验的有机副产物可能有(写出其中两种的结构简式).
(4)在第一次分离过程中,有机层从分液漏斗(填“上口倒出”或“下口放出”).
【答案】
(1)y
(2)防止溶液受热暴沸;溴乙烷的沸点较低,需要冷却减少其挥发;Br2+HSO3﹣+H2O=2Br﹣+SO42﹣+3H+、H++HSO3﹣=SO2↑+H2O(或Br2+4HSO3﹣=2Br﹣+SO42﹣+3SO2↑+2H2O)
(3)CH3CH2OCH2CH3、CH2=CH2
(4)下口放出
【解析】解:(l)采取逆流原理向冷凝管中通入冷凝水,能够充分冷凝,即从y通入冷凝水,所以答案是:y;(2)给混合液态加热易发生爆沸现象,碎瓷片的存在可以防止加热过程中产生暴沸现象;溴乙烷的沸点为38.4℃,其沸点较低,易挥发,需要将锥形瓶置于冰水浴中冷却降温,以便减少其挥发;
d中的馏出液略带橙红色,该物质为溴单质,溴单质具有氧化性,可用足量饱和NaHSO3溶液洗涤除去,反应的离子方程式为:Br2+HSO3﹣+H2O=2Br﹣+SO42﹣+3H+ , H++HSO3﹣=SO2↑+H2O或Br2+4HSO3﹣=2Br﹣+SO42﹣+3SO2↑+2H2O,
所以答案是:防止溶液受热暴沸;溴乙烷的沸点较低,需要冷却减少其挥发;Br2+HSO3﹣+H2O=2Br﹣+SO42﹣+3H+ , H++HSO3﹣=SO2↑+H2O(或Br2+4HSO3﹣=2Br﹣+SO42﹣+3SO2↑+2H2O);(3)乙醇在浓硫酸存在条件下加热可以发生消去反应生成乙烯:CH2=CH2 , 还能够发生分子间脱水生成乙醚:CH3CH2OCH2CH3 ,
所以答案是:CH3CH2OCH2CH3、CH2=CH2;(4)溴乙烷的密度大于水,则有机层在下层,应该从分液漏斗的下口放出,
所以答案是:下口放出.

 阅读快车系列答案
阅读快车系列答案