��Ŀ����
����Ŀ��ijһ������Ϊ���ۺ��������������еĸ���ƷCaSO4�������ڵĺϳɰ�����������������Ʊ�(NH4��2SO4�Ĺ������̣�
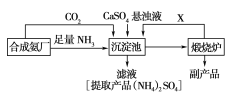
��ش��������⣺
��1���ϳɰ���Ӧ�Ļ�ѧ����ʽ��_____���������з�������Ҫ��Ӧ����ʽ��____________���÷�Ӧ�ܹ�������ԭ����______________________��
��2�����������̵ij�������ͨ������������Ŀ����_______________________________________������ѭ��ʹ�õ�X��________��
��3�������������еĸ���Ʒ��__������ɫ��ѧ����Դ�ۺ����õĽǶ�˵���������̵���Ҫ�ŵ���_____�������ʵ����ʺ�ҵ����ʵ�ʵĽǶȿ��Ǹ����̵���Ҫȱ����________________________________��
���𰸡���1��N2��3H2![]() 2NH3 CaSO4��CO2��2NH3��H2O===CaCO3����(NH4��2SO4 ���ɵ�CaCO3�ܽ��С��CaSO4�������ڷ�Ӧ������� ��2��һ�����ṩ��Ӧ���һ����ʹ��Һ�ʼ���������CO2������ CO2 ��3����ʯ�� �������У�������CO2ѭ��ʹ�ã��õ��IJ�Ʒ����Ʒ�����������ʣ�������� ����CaSO4�ܽ��С���˷�Ӧ�IJ��ʱȽϵ͡�
2NH3 CaSO4��CO2��2NH3��H2O===CaCO3����(NH4��2SO4 ���ɵ�CaCO3�ܽ��С��CaSO4�������ڷ�Ӧ������� ��2��һ�����ṩ��Ӧ���һ����ʹ��Һ�ʼ���������CO2������ CO2 ��3����ʯ�� �������У�������CO2ѭ��ʹ�ã��õ��IJ�Ʒ����Ʒ�����������ʣ�������� ����CaSO4�ܽ��С���˷�Ӧ�IJ��ʱȽϵ͡�
��������
�����������1����ҵ�ϳɰ��ķ�Ӧԭ��ΪN2+3H2 ![]() 2NH3����NH3��CO2ͨ��������в�����CaSO4������(NH4��2SO4��CaCO3������CaSO4+CO2+2NH3+H2O��CaCO3��+(NH4��2SO4�����ɵ�̼����ܽ�ȱ������С�������ڷ�Ӧ������У�
2NH3����NH3��CO2ͨ��������в�����CaSO4������(NH4��2SO4��CaCO3������CaSO4+CO2+2NH3+H2O��CaCO3��+(NH4��2SO4�����ɵ�̼����ܽ�ȱ������С�������ڷ�Ӧ������У�
��2����Һ�ʼ���������CO2�����գ�����ͨ��������������������һ���������ṩ��Ӧ�����ɹ������̿�֪��CaCO3������¯�зֽ�����CO2��CaO��CO2ѭ��ʹ�ã����ɵ�CO2��ѭ��ʹ����
��3���������Ϸ�����֪����Ʒ����ʯ����CaO���Ʊ�����ƣ�û�з�������������CaSO4�ܽ��С����˸���Ӧ�IJ��ʱȽϵ͡�