题目内容
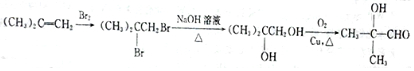
2.某芳香酸类物质F常用做香精的调香剂.F的-种合成路线如图:
己知:A能发生银镜反应.回答下列问题:
(1)(CH3)2=CH2的化学名称为2-甲基丙烯(或2一甲基-1-丙烯),上述反应①、②、③、④中属于取代反应的有取代反应.
(2)C的结构简式为
 ,D中通过反应②引入的官能团名称为氯原子.
,D中通过反应②引入的官能团名称为氯原子.(3)①的反应条件是浓硫酸、加热.
(4)④的化学方程式为CH2=C(CH3)COOH+
 $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$ +H2O.
+H2O.(5)B的同分异构体中,既能发生银镜反应又能发生水解反应的共有4种(不体异构),其中核磁共振氢谱显示为三组峰,且峰面积比为1:1:4的是
 (填结构简式).
(填结构简式).(6)写出用(CH3)2C=CH2为原料(无机试剂任选)制备化合物A的合成路线:
 .
.
分析 A能发生银镜反应,A含-CHO,结合氧化产物的碳链骨架可知,A为(CH3)2C(OH)CHO,①为-OH的消去反应生成B为CH2=C(CH3)COOH,结合F的C原子数为11,则C、D、E均含7个C原子,C为 ,C光照下发生取代反应生成D为
,C光照下发生取代反应生成D为 ,D发生水解反应生成E为
,D发生水解反应生成E为 ,B与E发生酯化反应生成F为
,B与E发生酯化反应生成F为 ,以此解答(1)~(5);
,以此解答(1)~(5);
(6)(CH3)2C=CH2先与卤素单质加成引入2个-X,后水解引入两个-OH,最后发生催化氧化反应,以此来解答.
解答 解:(1)(CH3)2=CH2的化学名称为2-甲基丙烯(或2一甲基-1-丙烯),由上述分析可知,①为消去反应,②③④均为取代反应,
故答案为:2-甲基丙烯(或2一甲基-1-丙烯);取代反应;
(2)C的结构简式为 ,D中通过反应②引入的官能团名称为氯原子,故答案为:
,D中通过反应②引入的官能团名称为氯原子,故答案为: ;氯原子;
;氯原子;
(3)①为醇的消去反应,则反应条件为浓硫酸、加热,故答案为:浓硫酸、加热;
(4)④的化学方程式为CH2=C(CH3)COOH+ $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$ +H2O,
+H2O,
故答案为:CH2=C(CH3)COOH+ $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$ +H2O;
+H2O;
(5)B为CH2=C(CH3)COOH,B的同分异构体中,既能发生银镜反应又能发生水解反应,含HCOO-,可连CH2=C(CH3)-、CH3CH=CH-、CH2=CHCH2-、 ,共4种同分异构体,其中核磁共振氢谱显示为三组峰,且峰面积比为1:1:4的是
,共4种同分异构体,其中核磁共振氢谱显示为三组峰,且峰面积比为1:1:4的是 ,
,
故答案为:4; ;
;
(6)(CH3)2C=CH2先与卤素单质加成引入2个-X,后水解引入两个-OH,最后发生催化氧化反应,合成流程为 ,故答案为:
,故答案为: .
.
点评 本题考查有机物的合成,为高频考点,把握合成流程中官能团变化、碳原子数变化、有机反应条件及有机反应为解答的关键,侧重分析与应用能力的考查,注意有机物性质的应用,题目难度不大.


下列关于绿原酸判断不正确的是( )
| A. | 绿原酸既可以催化加氢,1mol绿草酸最多消耗7molH2 | |
| B. | 绿原酸有一个官能团叫羧基 | |
| C. | 1 mol绿原酸与足量NaOH溶液反应,最多消耗4mol NaOH | |
| D. | 绿原酸可以与FeCl3溶液生显色反应 |
| A. | 乙烷(乙烯):光照条件下通入Cl2,气液分离 | |
| B. | 溴苯(液溴):用氢氧化钠溶液洗涤,分液 | |
| C. | 乙烯(SO2):气体通过盛酸性高锰酸钾溶液的洗气瓶 | |
| D. | 乙醇(水):加足量浓硫酸,蒸馏 |

某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两等份.向其中一份中逐渐加入铜粉,最多能溶解19.2 g(己知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
| A. | OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气 | |
| B. | 原混合酸中NO3-物质的量为0.4 mol | |
| C. | 第二份溶液中最终溶质为FeSO4 | |
| D. | 取20 mL原混合酸加水稀释至1 L后溶液c(H+)=0.1mol•L-l |
| A. | CuSO4溶液 | B. | 将Fe改为同质量的Na | ||
| C. | 改为用浓硫酸 | D. | NaNO3溶液 |
| A. | 铁 | B. | 氯气 | C. | 二氧化碳 | D. | 氯化钾 |
 (1)现有如下两个反应:
(1)现有如下两个反应:(A)NaOH+HCl═NaCl+H2O
(B)2FeCl3+Cu═2FeCl2+CuCl2
根据两反应本质,判断能设计成原电池的反应是B(填序号).
(2)氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置,是一种具有应用前景的绿色电源.下图为氢氧燃料电池原理示意图,按照此图的提示回答下列问题:
①该燃料电池的负极是a(写a或b).
②O2(写化学式)发生还原反应.
③燃料电池中是将化学能转化为电能,正极反应式是O2+2H2O+4e-=4OH-.
(3)锌锰干电池是最早使用的化学电池,其基本构造如下图所示.
 | 锌锰干电池的负极是锌,电路中每通过0.4mole-,消耗负极的质量13.0g;工作时NH+4离子在正极反应产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是2NH4++2e-═2NH3↑+H2↑. |
| A. | 4 mol NH3和5 mol O2反应,达到平衡时放出热量为905.9 kJ | |
| B. | 平衡时,$\frac{4}{5}$v正(O2)=v正(NO) | |
| C. | 平衡后降低压强,混合气体平均摩尔质量增大 | |
| D. | 平衡后升高温度,混合气体中NO含量降低 |