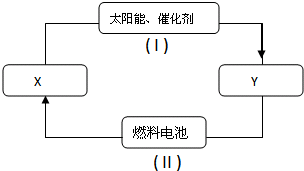
题目内容
由氢气和氧气反应生成1 mol水蒸气放热241.8 kJ,该反应的热化学方程式为________________。若1 g水蒸气转化为液态水放热2.444 kJ,则氢气的燃烧热为__________kJ·mol-1。
解析:18 g水蒸气变成液态水,放热2.444 kJ×18≈44 kJ,则氢气燃烧生成1 mol液态水共放热为241.8 kJ+44 kJ=285.8 kJ。
答案:H2(g)+![]() O2(g)
O2(g)![]() H2O(g) ΔH=-241.8 kJ·mol-1 285.8
H2O(g) ΔH=-241.8 kJ·mol-1 285.8

练习册系列答案
相关题目
 (1)(4分)2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ/mol.
(1)(4分)2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ/mol.