题目内容
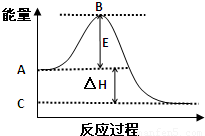
 (1)(4分)2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ/mol.
(1)(4分)2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ/mol.请回答下列问题:
①图中A点表示:
反应物的总能量
反应物的总能量
C点表示:
生成物的总能量
生成物的总能量
E的大小对该反应的反应热
无
无
(填“有”或“无”)影响.②图中△H=
-198
-198
kJ/mol.(2)(4分)由氢气和氧气反应生成1mol水蒸气,放出241.8kJ热量(25℃、101kPa下测得)
①写出该反应的热化学方程式:
H2( g )+
O2( g )=H2O ( g )△H=-241.8 kJ/mol
| 1 |
| 2 |
H2( g )+
O2( g )=H2O ( g )△H=-241.8 kJ/mol
| 1 |
| 2 |
②若1mol水蒸气转化为液态水放热45kJ,则反应H2(g)+
| 1 |
| 2 |
-286.8
-286.8
kJ/mol.氢气的燃烧热为△H=-286.8
-286.8
kJ/mol.分析:(1)①A、C分别表示反应物总能量的生成物总能量,B为活化能,活化能的大小与反应热无关;
②根据参加反应SO2的物质的量之比等于对应的△H之比;
(2)①氢气和氧气及水的状态知道,根据热量可写出热化学方程式;
②利用盖斯定律计算.
②根据参加反应SO2的物质的量之比等于对应的△H之比;
(2)①氢气和氧气及水的状态知道,根据热量可写出热化学方程式;
②利用盖斯定律计算.
解答:解:(1)①因图中A、C分别表示反应物总能量、生成物总能量,B为活化能,反应热可表示为A、C活化能的大小之差,活化能的大小与反应热无关,
故答案为:反应物总能量;生成物总能量;无;
②因1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1,所以2molSO2(g)氧化为2molSO3的△H=-198kJ?mol-1,
则2SO2(g)+O2(g)=2SO3(g)△H=-198KJ?mol-1,故答案为:-198;
(2)①生成1mol水需要0.5molO2,反应的热化学方程式为H2(g)+
O2(g)=H2O(g)△H=-241.8 kJ?mol-1,
故答案为:H2(g)+
O2(g)=H2O(g)△H=-241.8 kJ?mol-1.
②1mol水蒸气转化为液态水放热45kJ,根据盖斯定律可知反应H2(g)+
O2(g)=H2O(l)的△H=-(241.8+45)=-286.8 kJ?mol-1,所以氢气的燃烧热为△H=-286.8 kJ?mol-1,故答案为:-286.8;-286.8.
故答案为:反应物总能量;生成物总能量;无;
②因1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1,所以2molSO2(g)氧化为2molSO3的△H=-198kJ?mol-1,
则2SO2(g)+O2(g)=2SO3(g)△H=-198KJ?mol-1,故答案为:-198;
(2)①生成1mol水需要0.5molO2,反应的热化学方程式为H2(g)+
| 1 |
| 2 |
故答案为:H2(g)+
| 1 |
| 2 |
②1mol水蒸气转化为液态水放热45kJ,根据盖斯定律可知反应H2(g)+
| 1 |
| 2 |
点评:本题考查反应过程的能量变化图以及运用盖斯定律进行反应热的计算,难度不大,注意活化能与反应热的关系.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
 O2(g)=H2O(l)的△H=______kJ/mol.氢气的燃烧热为△H=______kJ/mol.
O2(g)=H2O(l)的△H=______kJ/mol.氢气的燃烧热为△H=______kJ/mol.