题目内容
某学生为了探究Zn与盐酸反应过程中的速率变化,在100mL稀盐酸中加入足量的Zn粉,用排水集气法收集反应放出的H2,实验记录如下(累计值):
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL)(标况下) | 50 | 120 | 232 | 290 | 310 |
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大 ,你认为原因是 。
(2)4~5 min时间段的反应速率最小,你认为原因是 。
(3)求2~3 min时间段内以盐酸的浓度变化来表示的反应速率(假设溶液体积保持不变)V(HCl)= 。
(4)如果反应太剧烈,为了减缓反应速率而又不减少产生氢气的量,在盐酸中分别加入下列物质:
A.H2O B.NaCl溶液 C.Na2CO3溶液 D.Cu粉 E.CuSO4粉末
你认为可行的是(填编号) 。
(1) 2~3,Zn与盐酸反应放热,温度越高,反应速率越大 (2)H+浓度变小。
(3)0.1mol·L-1·min-1。 (4)A、B
解析试题分析:(1)对于有气体产生的化学反应速率可以用相同的时间内产生氢气的多少或产生相同体积的氢气的时间的长短来表示。由时间与速率的关系表格可以看出在2~3min时反应速率最大。原因是在开始时尽管HCl的浓度大,但是反应的温度低,所以速率慢,由于Zn与盐酸反应放热,是反应溶液的温度升高,温度越高,反应速率越大。当反应进行一段时间后影响速率的主要因素是溶液的浓度,由于这时反应物的浓度逐渐变稀,所以速率又逐渐减小。(2)4~5 min时间段的反应速率最小,主要原因是这时影响化学反应速率的主要因素是HCl的浓度,这时HCl电离产生的H+浓度变小。(3)在2~3 min时间段内n(H2)="0.112L÷22.4L/mol=0.005mol,Δc(HCl)=" ="0.005mol×2÷0.1L=0.1mol/(L·min)." (4)如果反应太剧烈,为了减缓反应速率而又不减少产生氢气的量,在盐酸中分别加入下列物质:A.H2O对溶液起稀释作用,由于n(H+)不变,所以物质的量不变,但是由于浓度减小,所以速率减小。正确。B.NaCl溶液中的水对溶液起稀释作用,由于n(H+)不变,所以物质的量不变,但是由于浓度减小,所以速率减小。正确。C.Na2CO3溶液,会发生反应:Na2CO3+ 2HCl=2NaCl+H2O+ CO2↑,消耗了HCl,所以速率减小,产生氢气的物质的量也减小。错误。D.Cu粉,Zn、Cu和HCl构成原电池,化学反应速率大大加快,错误。E.CuSO4粉末,首先发生反应:CuSO4+Zn="Cu+" ZnSO4,产生的Cu及未反应的Zn和HCl构成原电池,大大加快反应速率。错误。
考点:考查化学反应速率的比较、影响因素及计算的知识。

(15分)已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)可逆反应FeO(s)+CO(g) Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
| T(K) | 938 | 1100 |
| K | 0.68 | 0.40 |
①写出该反应平衡常数的表达式__________。
②若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,若升高温度,混合气体的平均相对分子质量_____;充入氦气,混合气体的密度____(选填“增大”、“减小”、“不变”)。
(2)常温下,浓度均为0.1 mol·L-1的下列六种溶液的pH如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
②根据表中数据判断,浓度均为0.01 mol·L-1的下列五种物质的溶液中,酸性最强的是 ;
将各溶液分别稀释100倍,pH变化最小的是 (填编号)。
A.HCN B.HClO C.C6H5OH D.CH3COOH E.H2CO3
③据上表数据,请你判断下列反应不能成立的是 (填编号)。
A.CH3COOH+ Na2CO3=NaHCO3+CH3COONa B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO D.CO2+H2O+2C6H5ONa=Na2CO3+2C6H5OH
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为
(3)已知常温下Cu(OH)2的Ksp=2×10-20。又知常温下某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于 ;要使0.2 mol·L-1的CuSO4溶液中Cu2+沉淀较为完全 ( 使Cu2+浓度降至原的千分之一)则应向溶液里加NaOH溶液,使溶液pH为 。
Ⅰ.某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(1)写出上述实验中发生反应的化学方程式: ,该反应是 反应(填放热或吸热)。
(2)实验结果表明,催化剂的催化效果与 有关。
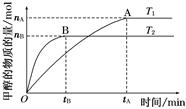
Ⅱ.某温度时在2L容器中X、Y、Z三种物质的物质的量(n)随时间(t)变化的曲线如右图所示,图中数据分析:
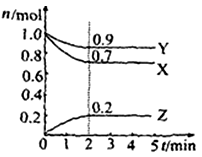
(1)该反应的化学方程式为: 。
(2)反应开始至2min,用Z表示的平均反应速率为: 。
(3)在密闭容器里,通入a mol X(g)和b mol Y(g),发生反应X(g) + Y(g) = 2Z(g),当改变下列条件时,反应速率会减小
A.降低温度 B.加入催化剂 C.增大容器体积
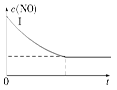
利用催化剂可使NO和CO发生反应:2NO(g)+2CO(g)??2CO2(g)+N2(g) ΔH<0。
已知增大催化剂的比表面积可提高化学反应速率。为了分别验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
| 实验 编号 | T(℃) | NO初始浓度 (mol·L-1) | CO初始浓度 (mol·L-1) | 催化剂的比表 面积(m2·g-1) |
| Ⅰ | 280 | 1.2×10-3 | 5.8×10-3 | 82 |
| Ⅱ | | 1.2×10-3 | | 124 |
| Ⅲ | 350 | | | 82 |
(2)实验Ⅰ中,NO的物质的量浓度(c)随时间(t)的变化如图所示。请在给出的坐标图中画出实验Ⅱ、Ⅲ中NO的物质的量浓度(c)随时间(t)变化的曲线,并标明各曲线的实验编号。
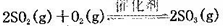 (正反应放热)。测得n(O2)随时间的变化如下表
(正反应放热)。测得n(O2)随时间的变化如下表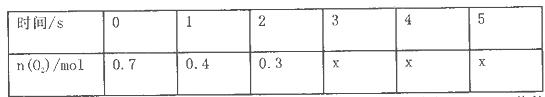
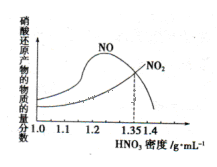
 的硝酸反应的化学方程式:______________________.
的硝酸反应的化学方程式:______________________.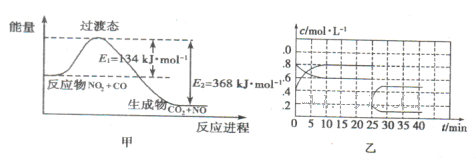
 N2O4(g) △H<0。现将一定量的NO2和N2O4混合气体通入体积为1L的恒温密闭容器中发生上述反应,反应物的浓度随时问变化关系如图乙所示。
N2O4(g) △H<0。现将一定量的NO2和N2O4混合气体通入体积为1L的恒温密闭容器中发生上述反应,反应物的浓度随时问变化关系如图乙所示。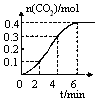
 pC(气) + qD(气)的 C %与时间 t有如图关系
pC(气) + qD(气)的 C %与时间 t有如图关系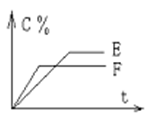
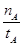 mol·L-1·min-1
mol·L-1·min-1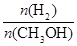 增大
增大