题目内容
下列物质的水溶液, pH>7的是
| A.NH4HSO4 | B.NaHCO3 | C.K2SO4 | D.FeCl3 |
B
试题分析:A.NH4HSO4= NH4++H++SO42-。溶液显酸性,PH<7.错误。B.NaHCO3是强碱弱酸盐,NaHCO3= Na++HCO3-电离产生的弱酸根离子水解消耗水电离产生的H+,破坏了水的电离平衡,使水继续电离,最终导致溶液显碱性,pH>7。正确。C.K2SO4是强酸与强碱发生完全中和得到的盐,不会发生水解反应,水的电离平衡未被破坏,水溶液中的氢离子和氢氧根离子的浓度仍然相等。所以溶液的PH=7.错误。D.FeCl3是强酸弱碱盐,弱碱根离子发生水解反应消耗了水电离产生的OH-离子,水的电离平衡被破坏,使水继电离,最终导致整个溶液显酸性,溶液的PH <7.错误。

练习册系列答案
相关题目
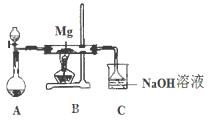
 2MgSO3+S;
2MgSO3+S; 2MgO+MgS,
2MgO+MgS,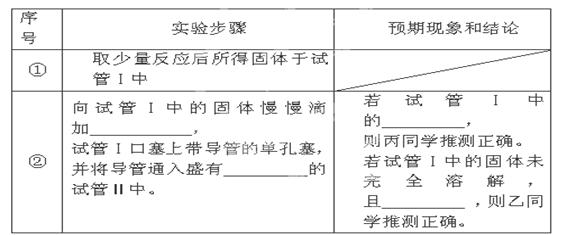
 CH3COO-+H2O
CH3COO-+H2O
