题目内容
2.下列有关乙烯的说法中错误的是( )| A. | 乙烯分子中所有原子在同一平面内 | |
| B. | 乙烯分子中含有的官能团是碳碳双键 | |
| C. | 乙烯在一定条件下能与水发生加成反应得到乙醇 | |
| D. | 乙烯能使酸性KMnO4溶液褪色,是因为发生了加成反应 |
分析 乙烯含碳碳双键,为平面结构,可与水发生加成反应,与高锰酸钾发生氧化反应,以此来解答.
解答 解:A.乙烯中C为sp2杂化,为平面结构,则所有原子在同一平面内,故A正确;
B.含有的官能团是碳碳双键,决定其化学性质,故B正确;
C.乙烯含碳碳双键,在一定条件下能与水发生加成反应得到乙醇,故C正确;
D.乙烯能使酸性KMnO4溶液褪色,是因为发生了氧化反应,故D错误;
故选D.
点评 本题考查乙烯的结构与性质,为高频考点,把握官能团与性质、有机反应为解答的关键,侧重分析与应用能力的考查,注意原子共面的判断,题目难度不大.

练习册系列答案
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案
相关题目
12.用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,2.24 L 乙醇中含有的碳原子数为0.2NA | |
| B. | 0.5 mol•L-1 NaOH溶液中,含Na+数目为0.5NA | |
| C. | C60和石墨的混合物共1.8 g,含碳原子数目为0.15NA | |
| D. | 常温常压下,1.12LCO2与足量的Na2O2反应转移的电子数目为0.05NA |
13.某原子晶体的基本结构单元是正二十面体,每个原子与另外五个原子相连,每个面均是正三角形,请分析该晶体的棱数和顶点数( )
| A. | 60、12 | B. | 12、30 | C. | 30、12 | D. | 10、30 |
10.阿伏加德罗常数约为6.02×1023 mol-1,下列叙述中正确的是( )
| A. | 1 mol Cl2参加反应,一定得2×6.02×1023个电子 | |
| B. | 在25℃,101 kPa时,14 g氮气中含有NA个原子 | |
| C. | 2.24 L CH4中含有的原子数为0.5×6.02×1023 | |
| D. | 250 mL 2 mol•L-1的氨水中含有NH3•H2O的分子数为0.5×6.02×1023 |
17.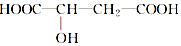 苹果醋是一种由苹果发酵而形成的具有解毒、降脂、减肥等药效的健康食品.苹果酸(2羟基丁二酸)是这种饮料的主要成分,苹果酸的结构简式如图所示.下列说法不正确的是( )
苹果醋是一种由苹果发酵而形成的具有解毒、降脂、减肥等药效的健康食品.苹果酸(2羟基丁二酸)是这种饮料的主要成分,苹果酸的结构简式如图所示.下列说法不正确的是( )
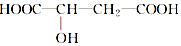 苹果醋是一种由苹果发酵而形成的具有解毒、降脂、减肥等药效的健康食品.苹果酸(2羟基丁二酸)是这种饮料的主要成分,苹果酸的结构简式如图所示.下列说法不正确的是( )
苹果醋是一种由苹果发酵而形成的具有解毒、降脂、减肥等药效的健康食品.苹果酸(2羟基丁二酸)是这种饮料的主要成分,苹果酸的结构简式如图所示.下列说法不正确的是( )| A. | 苹果酸在一定条件下能发生酯化反应 | |
| B. | 苹果酸在一定条件下能发生催化氧化反应 | |
| C. | 1 mol苹果酸与足量Na反应生成33.6 L H2(标准状况下) | |
| D. | 1 mol苹果酸与过量的Na2CO3溶液反应可生成1molCO2 |
7.下列关于188O的叙述中,错误的是( )
| A. | 质子数为8 | B. | 电子数为8 | C. | 中子数为8 | D. | 质量数为18 |
14.下列化合物的用途叙述正确的是( )
| A. | 光纤通信使用的光缆主要成分是晶体Si | |
| B. | 水玻璃可用作防火剂或防腐剂 | |
| C. | 氯水、酒精能杀菌消毒,都利用了强氧化性 | |
| D. | SO2可用来漂白纸浆、毛、草帽、增白食品等 |
11.H2O2被称为绿色氧化剂.如图是以甲烷燃料电池为电源,电解制备H2O2的示意图.下列有关叙述中正确的是
( )

( )

| A. | 电解池装置应选择阳离子交换膜 | |
| B. | d 极的电极反应式为:O2+2e-+2H+=H2O2 | |
| C. | 当有16g甲烷参与原电池反应时,可制备4 mol H2O2 | |
| D. | 工作时,a、c电极附近的pH均增大 |
6. 近年来AIST报告正在研制一种“高容量、低成本”的锂一铜空气燃料电池.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为:2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )
近年来AIST报告正在研制一种“高容量、低成本”的锂一铜空气燃料电池.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为:2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )
 近年来AIST报告正在研制一种“高容量、低成本”的锂一铜空气燃料电池.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为:2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )
近年来AIST报告正在研制一种“高容量、低成本”的锂一铜空气燃料电池.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为:2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )| A. | 放电时,Li+透过同体电解质向Cu极移 | |
| B. | 放电时,正极的电极反应式为O2+2H2O+4e-=4OH- | |
| C. | 通空气时,铜被腐蚀,表面产生Cu2O | |
| D. | 通空气时,整个反应过程中,铜相当于是催化剂 |