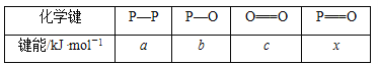
题目内容
【题目】化学电源在日常生活和工业生产中有着重要的应用。
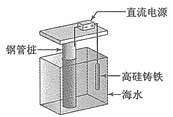
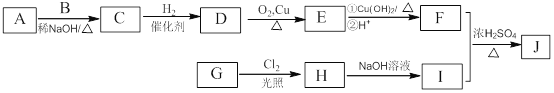
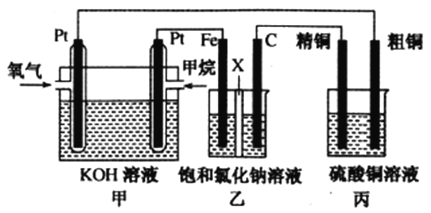
I.如下图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题
(1)甲烷燃料电池负极反应式是______________________。
(2)石墨(C)极的电极反应式为______________________。
(3)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁极上生成的气体体积为___________L;丙装置中阴极析出铜的质量为___________g,一段时间后烧杯中c(Cu2+)___________(填“增大”、“减小”或“不变”)
Ⅱ.“长征”火箭发射使用的燃料是液态偏二甲肼(C2H8N2),并使用四氧化二氮作为氧化剂,这种组合的两大优点是,既能在短时间内产生巨大能量将火箭送上太空,产物又不污染空气(产物都是空气成分)。某校外研究性学习小组拟将此原理设计为原电池,如图所示,结合学习过的电化学原理分析其设计方案,回答相关问题:
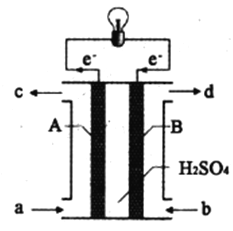
(4)从a口加入___________(填名称)。H+移动方向是___________(填“A到B”或“B到A”)
(5)A极发生的电极反应式:______________________。
(6)若以该电池为电源用石墨做电极电解200mL0.5mol/L的CuSO4溶液,电解一段时间后,两极收集到相同体积(相同条件)的气体,则整个电解过程转移的电子的数目是___________。
【答案】CH4-8e-+10OH-=CO32-+7H2O 2Cl--2e-=Cl2↑ 4.48 12.8 减小 偏二甲肼 A到B C2H8N2-16e-+4H2O=2CO2↑+N2↑+16H+ 0.4NA(或2.408×1023)
【解析】
I.从原电池或电解池电极反应式的书写、基于转移电子关系的相关计算进行分析;Ⅱ.考察了燃料电池(原电池原理)的电极反应式、电子流向以及转移的电子数目计算。
I.甲为燃料电池,甲烷通入一极为负极,氧气通入一极为正极;乙为电解池,Fe为阴极,C为阳极,实质为电解饱和食盐水;丙为电解池,粗铜为阳极,精铜为阴极,实质为电解精炼铜。
(1)、甲烷燃料电池负极为CH4,失去电子后结合OH-生成CO32-,其反应式是CH4-8e-+10OH-=CO32-+7H2O
本题答案:CH4-8e-+10OH-=CO32-+7H2O
(2)、乙为电解池,Fe为阴极,C为阳极,实质为电解饱和食盐水,故石墨(C)极的电极反应式为2Cl--2e-=Cl2↑
本题答案:2Cl--2e-=Cl2↑
(3)、标准状况下,2.24L氧气的物质的量为0.1mol,参与反应转移电子数为0.4mol ;铁电极为阴极,阳离子放电:2H++2e-=H2,则放出氢气0.2mol,标准状况下体积为4.48L;丙装置中阴极反应式为:Cu2++2e-=Cu,则析出铜0.2mol,即为12.8g。一段时间后烧杯中c(Cu2+)会减少。
本题答案:4.48;12.8;减小
(4)、外电路中电子由A电极流向B电极,由电子转移方向可知A为负极,B为正极,根据原电池原理,还原剂在负极上失去电子发生氧化反应,氧化剂在正极上得电子发生还原反应,则从a口通入偏二甲肼;内电路一般是阳离子向正极移动,阴离子向负极移动,所以H+移动方向是A到B
本题答案:偏二甲肼;A到B
(5)、A为负极,还原剂在负极上失去电子发生氧化反应,又已知产物中气体均为空气组分,所以A极发生的电极反应式C2H8N2-16e-+4H2O=2CO2↑+N2↑+16H+
本题答案:C2H8N2-16e-+4H2O=2CO2↑+N2↑+16H+
(6)、两极收集到相同体积(相同条件)的气体,则阴极除了Cu2++2e-=Cu,还应有2H++2e-=H2↑,阳极的电极反应式4OH--4e-=2 H2O+O2↑,设生成n(O2)=n(H2)=x,
因为n(Cu2+)=0.5mol/L×0.2 L=0.1 mol,由得失电子守恒0.1×2+2x=4x,x=0.1mol,所以n(O2)=n(H2)=0.1 mol,则整个电解过程转移的电子的数目是 0.1 mol×4=0.4 mol ,即0.4NA
本题答案:0.4NA

【题目】向20 mL 0.40 mol/L H2O2溶液中加入少量KI溶液:ⅰ.H2O2+I-=H2O+IO﹣;ⅱ.H2O2+IO﹣= H2O+O2↑+ I﹣。H2O2分解反应过程中能量变化和不同时刻测得生成O2的体积(已折算标准状况)如下。

t/min | 0 | 5 | 10 | 15 | 20 |
V(O2)/mL | 0.0 | 12.6 | 20.16 | 28.0 | 32.7 |
下列判断不正确的是
A. 从图中可以看出,KI能增大H2O2的分解速率
B. 反应ⅰ是放热反应,反应ⅱ是吸热反应
C. 0~10 min的平均反应速率:v(H2O2)≈9.0×10-3 mol/(L·min)
D. H2O2在反应过程中既体现了氧化性,又体现了还原性