题目内容
【题目】铜、硫的单质及其化合物在生产、生活中应用广泛,辉铜矿(主要成分是Cu2S)是冶炼铜和制硫酸的重要原料。
(1)已知:①2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) △H=-768.2kJ/mol
②2Cu2O(s)+ Cu2S(s)=6Cu(s)+ SO2(g) △H=+116.0kJ/mol
则Cu2S(s)+O2(g)=2Cu(s)+SO2(g) △H=__________。
(2)利用化石燃料开采、加工过程产生的H2S废气可制取氢气,既廉价又环保,若得到56L(标准状况)氢气,则转移的电子属为________。
(3)上述冶炼过程中会产生大量的SO2,回收处理SO2不仅能防止环境污染,而且能变害为宝。回收处理的方法之一是先将SO2转化为SO3,然后再转化为H2SO4。
①450℃时,某恒容密闭容器中存在反应:2SO2(g)+O2(g)![]() 2SO2(g)△H<0,下列事实能表明该反应达到平衡的是___________。
2SO2(g)△H<0,下列事实能表明该反应达到平衡的是___________。
A.容器内气体密度不变 B.O2、SO2的消耗速率之比为1:2
C.n(SO2):n(O2):n(SO3)=2:1:2 D.容器内压强不再发生交化
②450℃、0.1Mpa下,将2.0molSO2和1.0molO2置于5L密闭容器中开始反应,保持温度和容器体积不变,SO2的转化率(a)随着时间(t)的变化如图1所示。则该温度下反应的平衡常数K=_____。若维持其他条件不变,使反应开始时温度升高到500℃ ,请在图l中画出反应从开始到平衡时SO2转化率的变化图像_______。
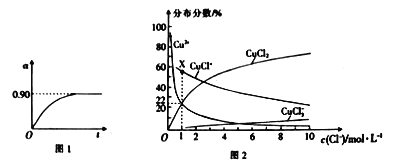
(4)已知CuCl2溶液中,铜元素的存在形式与c(Cl-)的相对大小有关,具体情况如图2所示(分布分数是指平衡体系中各含铜微粒物质的量占铜元素总物质的量的百分比)。
①若溶液中含铜微粒的总浓度为amol/L,则X点对应的c(CuCl+)=___________ (用含a的代数式表示)。
②向c(Cl-)=1mol/L的氯化铜溶液中滴人少量AgNO3溶液,则浓度最大的含铜微粒发生反应的离子方程式为__________。
【答案】 -217.4kJ·mol-1 3.01×1024(写“5NA”也给分) D 4050 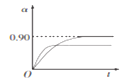 0.56amol·L-1 CuCl++Ag+═AgCl↓+Cu2+
0.56amol·L-1 CuCl++Ag+═AgCl↓+Cu2+
【解析】(1)①2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g)△H=-768.2kJmol-1 ,②2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)△H=+116.0kJmol-1 ,将方程式![]() ×(①+②)得Cu2S(s)+O2(g)=2Cu(s)+SO2(g)△H=
×(①+②)得Cu2S(s)+O2(g)=2Cu(s)+SO2(g)△H=![]() ×(768.2+116.0)kJ/mol=-217.4kJ/mol,故答案为:-217.4kJ/mol;
×(768.2+116.0)kJ/mol=-217.4kJ/mol,故答案为:-217.4kJ/mol;
(2) 标准状况下56 L氢气的物质的量为![]() =2.5mol,生成过程中H元素的化合价由+1变成0,则转移的电子数为2.5mol×2×6.02×1023=3.01×1024,故答案为:3.01×1024;
=2.5mol,生成过程中H元素的化合价由+1变成0,则转移的电子数为2.5mol×2×6.02×1023=3.01×1024,故答案为:3.01×1024;
(3)①A.反应前后气体总质量不变、容器体积不变,所以容器内气体密度始终不变,不能据此判断平衡状态,故错误;B.无论反应是否达到平衡状态都存在O2、SO2的消耗速率之比为1:2,不能据此判断平衡状态,故错误;C.n(SO2):n(O2):n(SO3)=2:1:2时该反应不一定达到平衡状态,与反应初始浓度及转化率有关,不能据此判断平衡状态,故错误;D.反应前后气体物质的量减小、压强减小,当容器内压强不再发生变化时正逆反应速率相等反应达到平衡状态,故正确;故选D;
②根据图知,二氧化硫的转化率为90%,开始时c(SO2)= ![]() =0.4mol/L、c(O2)=
=0.4mol/L、c(O2)= ![]() =0.2mol/L,参加反应的c(SO2)=0.4mol/L×90%=0.36mol/L,
=0.2mol/L,参加反应的c(SO2)=0.4mol/L×90%=0.36mol/L,
该反应 SO2(g)+O2(g) ![]() 2SO3(g)
2SO3(g)
开始(mol/L)0.4 0.2 0
反应(mol/L)0.36 0.18 0.36
平衡(mol/L)0.04 0.02 0.36
化学平衡常数K=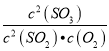 =
=![]() =4050;升高温度正逆反应速率都增大,反应到达平衡的时间缩短,升高温度平衡逆向移动,二氧化硫转化率降低,其图象为
=4050;升高温度正逆反应速率都增大,反应到达平衡的时间缩短,升高温度平衡逆向移动,二氧化硫转化率降低,其图象为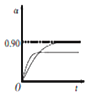 ,故答案为:4050;
,故答案为:4050; ;
;
(4)①若溶液中含铜微粒的总浓度为amolL-1,则X点对应的c(CuCl+)=amol/L×(1-22%-22%)=0.56amo/L,故答案为:0.56amol/L;
②根据图知,氯离子浓度减小,含铜微粒有CuCl+变为Cu 2+,反应离子方程式为CuCl++Ag+=AgCl↓+Cu2+,故答案为:CuCl++Ag+=AgCl↓+Cu2+。