题目内容
16.NA为阿伏加德罗常数的数值,下列说法中正确的是( )| A. | 1mol C6H14分子中共价键总数为20NA | |
| B. | 1mol乙基(-CH2CH3)电子总数17NA | |
| C. | 常温常压下,26g苯乙烯和苯组成的混合物中所含有的碳原子数为4NA | |
| D. | 标准状况下,22.4L甲醇的分子数中所含羟基数为NA |
分析 A、根据己烷分子含有的碳碳共价键和碳氢共价键数目计算出1mol己烷中含有的共价键数目;
B、乙基含有17个电子,计算分析;
C、苯乙烯和苯组成中碳氢原子个数比相等;
D、标况下,甲醇为液态;
解答 解:A、1mol己烷中含有5mol碳碳共价键和14mol碳氢共价键,总共含有19mol共价键,共价键总数为 19NA,故A错误;
B、乙基含有17个电子,1mol乙基(-CH2CH3)电子总数17 NA,故B正确;
C、苯乙烯和苯组成中碳氢原子个数比相等,最简式为CH,常温常压下,26g苯乙烯和苯组成的混合物中所含有的碳原子数为$\frac{26g}{13g/mol}$×NA=2NA,故C错误;
D、标况下,甲醇为液态,22.4L甲醇物质的量不是1mol,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是微粒数计算,气体摩尔体积的条件分析应用,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
6.反应A(g)+3B(g)?2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
( )
( )
| A. | v(D)=0.40mol•L-1•s-1 | B. | v(C)=0.50mol•L-1•s_1 | ||
| C. | v(A)=0.30mol•L-1•s-1 | D. | v(B)=0.60mol•L-1•s-1 |
4.设NA表示阿伏加德罗常数的值,下列有关NA的叙述中正确的是( )
| A. | 惰性电极电解饱和食盐水,若电路中通过NA个电子,则阳极产生气体11.2L | |
| B. | 标准状况下,4.0 g CH4中含有共价键的数目为NA | |
| C. | 1 mol C12发生化学反应,转移的电子数必为2NA | |
| D. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA |
11.下列关于有机物的说法正确的是( )
| A. | 乙烯和苯都能使溴水褪色,褪色的原因相同 | |
| B. | 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 | |
| C. | 葡萄糖和果糖的分子式均为C6H12O6,二者互为同系物 | |
| D. | 乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去 |
8.一定温度下,向a L密闭容器中加入2mol NO2(g),发生反应:2NO2?2NO+O2,此反应达到平衡状态时的标志是( )
| A. | 混合气体的颜色变浅 | |
| B. | 混合气体的密度不再变化 | |
| C. | 混合气体中NO2、NO、O2物质的量之比为2:2:1 | |
| D. | 单位时间内生成2n mol NO,同时生成2n mol NO2 |
5.下列有关同分异构体数目的叙述错误的是( )
| A. | 分子式为C7H8O,且属于芳香族化合物的同分异构体只有4种 | |
| B. | 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物最多有6种 | |
| C. | 丙烷的一氯代物有2种,丙烷的二氯代物有4种 | |
| D. | 联苯(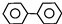 )的一氯代物有3种,二氯代物有12种 )的一氯代物有3种,二氯代物有12种 |
6.Ⅰ:图A为“人教版”教材制备乙酸乙酯的实验装置,某同学认为图B装置进行酯化反应效果比A要好,他的理由是便于冷凝回流,减少反应物损失.

Ⅱ:为了研究同周期元素性质递变规律,某同学设计了如下实验方案:
(1)表中的“实验步骤”与“实验现象”前后不是对应关系的是:①②
(2)由上述实验可得出的结论是:同周期元素从左到右金属性逐渐减弱
Ⅲ:某实验小组欲探究碳与浓硝酸反应的情况.甲同学设计了图1装置,认为若有红棕色气体产生就说明碳与浓硝酸发生了反应.
(1)甲同学的实验应该在通风橱中进行,才符合化学实验安全性的要求.
(2)乙同学认为红棕色气体不一定是碳与浓硝酸发生反应而得,可能是浓硝酸受热分解产生的红棕色气体,请写出浓硝酸受热分解的化学方程式4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+O2↑+2H2O,所以他认为应该检验CO2(填化学式)的产生来证明碳与浓硝酸反应.为此乙同学查阅相关资料得知“0℃时四氧化二氮为液体”,从而改进了实验装置如图2所示.
(3)为了减少干扰,对于A装置有下面4种操作方案,其中最合理的是②.
①将木炭与浓硝酸一同放在装置中加热;②先加热木炭,再将木炭投入冷浓硝酸;
③先加热木炭,再加入冷浓硝酸;④先加热浓硝酸,然后将木炭投入其中.
(4)请用平衡移动原理解释B装置的作用常温下存在平衡体系:2NO2?N2O4,降低温度N2O4液化,平衡右移,除去混合气体中的NO2(结合方程式与文字表述).
(5)若同意碳与浓硝酸反应生成二氧化氮的观点.将C装置所得的悬浊液过滤、洗涤、干燥、冷却、称量,所得固体质量为m克,则被还原的HNO3的质量为:$\frac{4×63×m}{197}$g(列出计算表达式即可).(忽略空气中二氧化碳的影响.相对原子质量:H 1 C 12 N 14 O 16 Ba 137)

Ⅱ:为了研究同周期元素性质递变规律,某同学设计了如下实验方案:
(1)表中的“实验步骤”与“实验现象”前后不是对应关系的是:①②
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | 镁浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色. |
| ②在盛有冷水的烧杯中滴入几滴酚酞溶液,再将一小块金属钠放入其中 | 有气体产生,溶液变成浅红色 |
| ③将镁条投入稀盐酸中 | 剧烈反应,迅速产生大量无色气体 |
| ④将铝条投入稀盐酸中 | 反应不十分剧烈;产生无色气体 |
| ⑤向A1Cl3溶液中滴加NaOH溶液至过量 | 生成白色胶状沉淀,继而沉淀消失 |
Ⅲ:某实验小组欲探究碳与浓硝酸反应的情况.甲同学设计了图1装置,认为若有红棕色气体产生就说明碳与浓硝酸发生了反应.
(1)甲同学的实验应该在通风橱中进行,才符合化学实验安全性的要求.
(2)乙同学认为红棕色气体不一定是碳与浓硝酸发生反应而得,可能是浓硝酸受热分解产生的红棕色气体,请写出浓硝酸受热分解的化学方程式4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+O2↑+2H2O,所以他认为应该检验CO2(填化学式)的产生来证明碳与浓硝酸反应.为此乙同学查阅相关资料得知“0℃时四氧化二氮为液体”,从而改进了实验装置如图2所示.
(3)为了减少干扰,对于A装置有下面4种操作方案,其中最合理的是②.
①将木炭与浓硝酸一同放在装置中加热;②先加热木炭,再将木炭投入冷浓硝酸;
③先加热木炭,再加入冷浓硝酸;④先加热浓硝酸,然后将木炭投入其中.
(4)请用平衡移动原理解释B装置的作用常温下存在平衡体系:2NO2?N2O4,降低温度N2O4液化,平衡右移,除去混合气体中的NO2(结合方程式与文字表述).
(5)若同意碳与浓硝酸反应生成二氧化氮的观点.将C装置所得的悬浊液过滤、洗涤、干燥、冷却、称量,所得固体质量为m克,则被还原的HNO3的质量为:$\frac{4×63×m}{197}$g(列出计算表达式即可).(忽略空气中二氧化碳的影响.相对原子质量:H 1 C 12 N 14 O 16 Ba 137)
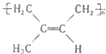 :其1mol单体跟1molBr2发生加成反应生成的产物有3种;
:其1mol单体跟1molBr2发生加成反应生成的产物有3种; .
.