题目内容
17.两种硫酸溶液,一种物质的量浓度为C1mol/L,密度为ρ1g/cm3,另一种物质的量浓度为C2mol/L,密度为ρ2g/cm3,当它们等体积混合后,溶液的密度为ρ3g/cm3,则混合溶液的物质的量浓度为( )| A. | $\frac{({C}_{1}+{C}_{2}){ρ}_{3}}{100({ρ}_{1}+{ρ}_{2})}$ | |
| B. | <“m“:math xmlns:dsi='http://www.dessci.com/uri/2003/MathML'dsi:zoomscale='150'dsi:_mathzoomed='1'style='CURSOR:pointer; DISPLAY:inline-block'>100(C1+C2)ρ3ρ1+ρ2$\frac{100({C}_{1}+{C}_{2}){ρ}_{3}}{{ρ}_{1}+{ρ}_{2}}$ | |
| C. | $\frac{({C}_{1}+{C}_{2}){ρ}_{3}}{100({ρ}_{1}+{ρ}_{2})}$ | |
| D. | $\frac{({C}_{1}+{C}_{2}){ρ}_{3}}{{ρ}_{1}+{ρ}_{2}}$ |
分析 设溶液体积都为1L,计算出两种硫酸溶液的质量,混合后的硫酸溶液质量为两种硫酸溶液的质量之和,再利用密度计算混合后的体积,根据混合后硫酸的物质的量为原两种硫酸溶液中硫酸的物质的量计算浓度.
解答 解:设溶液体积都为1L,则混合后硫酸溶液的质量为1000ml×ρ1g/ml+1000ml×ρ2g/ml=1000(ρ1+ρ2)g.
所以混合后的硫酸溶液的体积为$\frac{1000(ρ1+ρ2)g}{ρ3g/ml}$=1000×$\frac{ρ1+ρ2}{ρ3}$ml=$\frac{ρ1+ρ2}{ρ3}$L.
令混合后的物质的量浓度为c,则:
1L×C1 mol/L+1L×C2 mol/L=$\frac{ρ1+ρ2}{ρ3}$L×c
解得,c=$\frac{(C1+C2)ρ3}{ρ1+ρ2}$.
故选:D
点评 本题考查物质的量浓度计算,属于字母型计算,增大计算难度,注意对公式的理解与灵活应用,掌握物质的量浓度与质量分数关系,可以利用定义式计算,难度中等.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
6.Mg(OH)2可用作塑料的阻燃剂.现以某矿石(主要成分为3MgO•2SiO2•2H2O,还有少量Fe2O3、FeO、CaO和Al2O3)为原料生产,其工艺流程如下:
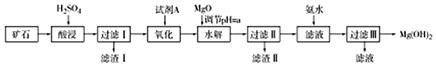
已知:
表1生成氢氧化物沉淀的pH
表2原料价格表
回答下列问题:
(1)酸浸时,为提高矿石的浸出率可采取的措施为将矿石粉碎(任写一条).该过程H2SO4适当过量的目的是使固体充分溶解、使Ca2+以CaSO4沉淀形式除去.
(2)工业生产要求生产成本较低,产品尽量不含杂质.试剂A的最佳选择是漂液(或NaClO),写出其发生反应的离子方程式2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(3)水解过程需调节溶液pH,a的取值范围为4.7≤a<9.1,滤渣II的成分是Fe(OH)3、Al(OH)3(填化学式).
(4)向过滤II所得滤液中加入一定量氨水,写出镁离子沉淀的离子方程式Mg2++2NH3•H2O=Mg(OH)2↓+2NH4+,该过程温度不宜过高的原因是氨水受热分解.
(5)实际生产中,可由Mg(OH)2为原料制备单质镁,简述制备方法Mg(OH)2与盐酸反应生产MgCl2,蒸发浓缩冷却结晶得到MgCl2•6H2O晶体,在HCl气流中加热失水得到无水MgCl2,电解熔融的MgCl2制取金属Mg.

已知:
表1生成氢氧化物沉淀的pH
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀的pH | 7.6 | 1.9 | 3.4 | 9.1 |
| 完全沉淀的pH | 9.6 | 3.2 | 4.7 | 11.1 |
| 物质 | 价格(元•吨-1) |
| 漂液(含25.2% NaClO) | 450 |
| 双氧水(含30%H2O2) | 2400 |
(1)酸浸时,为提高矿石的浸出率可采取的措施为将矿石粉碎(任写一条).该过程H2SO4适当过量的目的是使固体充分溶解、使Ca2+以CaSO4沉淀形式除去.
(2)工业生产要求生产成本较低,产品尽量不含杂质.试剂A的最佳选择是漂液(或NaClO),写出其发生反应的离子方程式2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(3)水解过程需调节溶液pH,a的取值范围为4.7≤a<9.1,滤渣II的成分是Fe(OH)3、Al(OH)3(填化学式).
(4)向过滤II所得滤液中加入一定量氨水,写出镁离子沉淀的离子方程式Mg2++2NH3•H2O=Mg(OH)2↓+2NH4+,该过程温度不宜过高的原因是氨水受热分解.
(5)实际生产中,可由Mg(OH)2为原料制备单质镁,简述制备方法Mg(OH)2与盐酸反应生产MgCl2,蒸发浓缩冷却结晶得到MgCl2•6H2O晶体,在HCl气流中加热失水得到无水MgCl2,电解熔融的MgCl2制取金属Mg.
12.下列属于纯净物的是( )
| A. | 水玻璃 | B. | 漂白粉 | ||
| C. | 盐酸 | D. | 氧元素质量分数为50%的SO2 |
2.在下列溶液中分别通入足量的CO2,最终产生沉淀的是( )
| A. | 氯化钙 | B. | 氢氧化钙 | C. | 氯化钠 | D. | 偏铝酸钠 |
6.下列实验操作或对实验相关的描述,正确的是( )
| A. | 皮肤上不慎沾到少量浓硫酸,应先用干抹布擦拭、再用大量水冲洗 | |
| B. | 检验HCl气体中是否混有Cl2,可将气体通入硝酸银溶液 | |
| C. | 验证某气体中含CO2、SO2,可依次通入品红溶液、饱和NaHCO3溶液、澄清石灰水 | |
| D. | 检验Fe2(SO4)3溶液中是否含有Fe2+,可用KMnO4酸性溶液 |
7.化合物A分子式为C8H8O2分子中苯环(C6H5-)上只有一个取代基,其红外光谱与核磁共振氢谱如图.关于A的下列说法中,正确的是( )


| A. | 核磁共振氢谱数据在推理A的结构式时用处不大 | |
| B. | A的结构式可表示为C6H5-COOH | |
| C. | 符合题中A分子结构特征的有机物有2种 | |
| D. | 碥定A的分子结构还需要实验数据 |
 ;化合物BA4的电子式为
;化合物BA4的电子式为 .
.