题目内容
铝是地壳中含量最多的金属元素,1854年法国化学家德维尔用金属钠还原氯化钠和氯化铝的复盐,获得了铝单质。1886年,美国人豪尔和法国人海郎特,分别独立地电解熔融的氧化铝和冰晶石的混合物,制得了金属铝,奠定了今天大规模生产铝的基础。
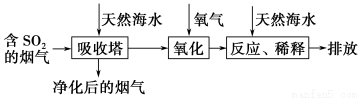
工业生产金属铝的原料是铝土矿(主要成分为Al2O3,另含有Fe2O3和SiO2),工业中得到较纯氧化铝的过程如下图所示:

试回答下列问题:
(1)操作Ⅰ是一种重要的混合物分离方法,实验室进行该项操作用到的玻璃仪器有烧杯、________、________。
(2)经分析不溶物A的主要成分为________。
(3)工业上电解冶炼铝的化学方程式为________________,若电路中通过1 mol电子,可以得到铝________g。
(4)为了提高综合经济效益,实际工业生产中常将上述反应中的相关物质循环利用。其部分转化关系如下图所示:

①上述转化中未涉及四种基本反应类型中的________反应;
②写出过程③的化学方程式:____________。
(5)科学研究表明,人体过量吸入铝元素会严重危害身体健康。请你结合实际提出两条杜绝铝元素过量吸入的措施:____________。
(1)漏斗 玻璃棒
(2)Fe2O3和SiO2(提示:Fe2O3不溶于水,且不与NaOH溶液反应;SiO2属于原子晶体,常温下与NaOH反应的速率很慢)
(3)2Al2O3 4Al+3O2↑ 9
4Al+3O2↑ 9
(4)①置换 ②NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O
(5)不用铝制品作炊具;不用铝箔包装食品(其他合理答案也可)
【解析】本题考查工业提取铝的流程实验。铝土矿加碱溶解后,溶液A为NaAlO2,不溶物为Fe2O3和SiO2,在NaAlO2溶液中通入CO2可生成Al(OH)3和NaHCO3,Al(OH)3受热分解生成Al2O3,Al2O3电解产生金属铝,方程式为2Al2O3 4Al+3O2↑,该反应中产生4 mol铝需要转移电子为12 mol,则转移1 mol电子可以得到铝
4Al+3O2↑,该反应中产生4 mol铝需要转移电子为12 mol,则转移1 mol电子可以得到铝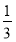 mol,即为9 g;(4)B为NaHCO3,根据题意可知,物质X为CaCO3,高温分解产生CaO和CO2,CaO与水反应生成Ca(OH)2,Ca(OH)2与NaHCO3反应生成NaOH和CaCO3,反应①为分解反应,反应②为化合反应,反应③为复分解反应。
mol,即为9 g;(4)B为NaHCO3,根据题意可知,物质X为CaCO3,高温分解产生CaO和CO2,CaO与水反应生成Ca(OH)2,Ca(OH)2与NaHCO3反应生成NaOH和CaCO3,反应①为分解反应,反应②为化合反应,反应③为复分解反应。

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g) nY(g) ΔH=Q kJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
nY(g) ΔH=Q kJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
气体体积/L c(Y)/(mol·L-1) 温度/℃ | 1 | 2 | 3 |
100 | 1.00 | 0.75 | 0.53 |
200 | 1.20 | 0.90 | 0.63 |
300 | 1.30 | 1.00 | 0.70 |
下列说法正确的是( )
A.m>n
B.Q<0
C.温度不变,压强增大,Y的质量分数减小
D.体积不变,温度升高,平衡向逆反应方向移动