题目内容
16. 乙基香兰素是当今世界上最重要的合成香料之一,是食品添加剂中不可缺少的重要原料,其结构简式如图所示.
乙基香兰素是当今世界上最重要的合成香料之一,是食品添加剂中不可缺少的重要原料,其结构简式如图所示.(1)以下推测不正确的是AB(填字母)
A.乙基香兰素能与FeCL2溶液反应
B.香兰素的分子式应为C9H10O3
C.乙基香兰素应密封保存
D.乙基香兰素的1个分子内最多有18个原子共面
(2)乙基香兰素的同分异构体X,其分子中苯环上有2个取代基.X可以发生水解反应生成M和N两种有机物.M可与饱和溴水反应生成白色沉淀,N的质谱图显示相对分子质量为32,红外光谱图上发现有O-H键、C-H键和C-O键的振动吸收.写出2种符合上述要求的X的结构简式:
 、
、 ;
; .
.(3)乙基香兰素的另一种同分异构体Y,分子中苯环上只有1个取代基,它可以和碳酸氢钠反应生成CO2.Y还能发生下列变化:

①Y分子中含氧官能团的名称是羟基、羧基.
②由Y→B的反应属于取代反应.
③A与新制Cu(OH)2反应的化学方程式是
 .
.④由B生成C的化学方程式是
 .
.⑤Y发生缩聚反应所得产物的结构简式是
 .
.
分析 (1)根据乙基香兰素含有的官能团和苯环的结构特点判断可能具有的性质;
(2)M可与饱和溴水反应生成白色沉淀,说明苯环上含有-0H,N的质谱图显示相对分子质量为32,红外光谱图上发现有O-H键、C-H键和C-O键的振动吸收,则N为CH3OH,则X应为羟基苯乙酸甲酯,两种取代基有邻、间、对位置;
(3)乙基香兰素的另一种同分异构体Y,分子中苯环上只有1个取代基,它可以和碳酸氢钠反应生成CO2,说明含有-COOH,
A能发生银镜反应,说明A中含有-CHO,则Y中应含有-CH2OH,则Y为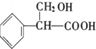 ,B为
,B为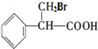 ,
,
C能发生加成反应,由B消去反应生成,结构式为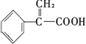 ,以此解答该题.
,以此解答该题.
解答 解:(1)A.该物质含有酚羟基,能氯化铁反应,不与氯化亚铁反应,故A错误;
B.乙基香兰素的分子式应为C9H10O3,而香兰素的分子式应为C7H6O3,故B错误;
C.乙基香兰素含有酚羟基,容易被氧气氧化,所以应密封保存,故C正确;
D.根据苯环中所有原子共面,碳氧双键中所有原子共面,单键可以旋转的特点,可知该分子内最多有18个原子共面,故D正确,
故答案为:AB;
(2)M可与饱和溴水反应生成白色沉淀,说明苯环上含有-0H,N的质谱图显示相对分子质量为32,红外光谱图上发现有O-H键、C-H键和C-O键的振动吸收,则N为CH3OH,X和乙基香兰素互为同分异构体,分子式为C9H10O3,则X应为羟基苯乙酸甲酯,两种取代基有邻、间、对位置,结构为 、
、 、
、 ,
,
故答案为: ;
; ;
; (其中任意两个);
(其中任意两个);
(3)①乙基香兰素的另一种同分异构体Y,分子中苯环上只有1个取代基,它可以和碳酸氢钠反应生成CO2,说明含有-COOH,
A能发生银镜反应,说明A中含有-CHO,则Y中应含有-CH2OH,则Y为 ,分子中含有羧基和羟基,
,分子中含有羧基和羟基,
故答案为:羟基、羧基;
②Y为 ,B为
,B为 ,发生的为取代反应,
,发生的为取代反应,
故答案为:取代反应;
③A为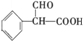 ,含有-CHO,与氢氧化铜在加热条件下发生:
,含有-CHO,与氢氧化铜在加热条件下发生: ,
,
故答案为: ;
;
④B为 ,C结构式为
,C结构式为 ,B发生消去反应生成C,
,B发生消去反应生成C,
反应的化学方程式为 ,
,
故答案为: ;
;
⑤Y为 ,分子中含有-OH、-COOH,能发生缩聚反应生成
,分子中含有-OH、-COOH,能发生缩聚反应生成 ,
,
故答案为: .
.
点评 本题考查有机物的结构和性质,题目难度中等,本题注意把握有机物的官能团的结构和性质,为解答该题题目的关键,注意同分异构体的判断.

| A. | 同样是在氯气中点燃,铁少量生成的是氯化铁,过量时则生成氯化亚铁 | |
| B. | 同样是试纸检测,检验气体需要润湿,检验溶液时则一般不能润湿 | |
| C. | 同样是配制溶液,一定质量分数的溶液配制使用烧杯,而一定物质的量浓度的溶液配制则还需要容量瓶 | |
| D. | 同样是浓溶液(设其质量分数为ω )与水等体积混合,所得硫酸的浓度大于 0.5ω,氨水的则小于 0.5ω |
(1)用CO2来生产燃料甲醇的反应原理为:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),某些化学键的键能数据如下表:
| 化学键 | C-H | H-H | C-O | C=O | H-O |
| 键能/kj•mol-1 | a | b | c | d | e |
(2)在溶液中,NaH2PO4和Na3PO4等物质的量混合恰好完全反应,该反应的离子方程式为H2PO4-+PO43-=2HPO42-,
(3)某温度(t℃)时,测得0.01mol•L-1的NaOH溶液的pH=10.在此温度下,将0.01mol•L-1的H2SO4溶液VaL与P
H=12的NaOH溶液VbL混合,若所得混合液pH=11,则Va:Vb=15:2.
(4)在25℃时,将cmol•L-1的醋酸溶液与bmol•L-1NaOH溶液等体积混合后溶液刚好呈中性,用含b、c的代数式表示CH3COOH的电离常数Ka=$\frac{b×1{0}^{-7}}{c-b}$.
(5)三种弱酸HA、H2B、HC,电离平衡常数的数值为:①1.8×10-5、②5.6×10-11、③4.9×10-10、④4.3×10-2(数据顺序以打乱),已知三种酸和它们的盐之间能发生以下反应:HA+HB-(少量)=A-+H2B,H2B(少量)+C-=HB-+HC.则三种酸对应的电离平衡常数分别为(请用序号填空)
| HA | H2B | HC | ||
| Ka | Ka1 | Ka2 | Ka3 | Ka4 |
| 数值 | ||||
| A. | Ca2+、HCO3-、Cl-、K+ | B. | OH-、CO32-、Cl-、K+ | ||
| C. | Ba2+、Na+、OH-、NO3- | D. | Cu2+、NO3-、OH-、Cl- |
| A. | 氯化钠和盐酸溶于水都发生电离,克服粒子间作用力的类型相同 | |
| B. | 氯化铵和水玻璃都属于离子化合物 | |
| C. | 直径介于1nm-10nm之间的微粒称为胶体 | |
| D. | 由IA族和VIA族元素可以形成含有原子个数比为l:1,离子个数比为2:l的离子化合物 |
| A. | 胃舒平中含有氢氧化铝,可治疗胃酸过多:Al(OH)3+3HCl═AlCl3+3H2O | |
| B. | 碳铵是一种常用化肥,60℃分解完全:2NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO2↑+H2O↑ | |
| C. | 生石灰可用作建筑材料:CaO+H2O=Ca(OH)2,属于化合反应 | |
| D. | 实验室常用氧化还原反应制备氧气:2H2O2 $\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑ |
| A. | 根据醋酸溶液中分子和离子共存,即可证明溶液达到了电离平衡状态 | |
| B. | c(CH3COO-)=c(H+),则醋酸溶液达到电离平衡状态 | |
| C. | 当NH3•H2O达到电离平衡时,溶液中NH3•H2O和OH-的浓度肯定相等 | |
| D. | 磷酸是分步电离的,电离程度依次减弱 |