题目内容
氨和联氨(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。根据题意完成下列计算:
(1) 联氨用亚硝酸氧化生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,计算确定该氢化物的分子
联氨用亚硝酸氧化生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,计算确定该氢化物的分子 式为________。该氢化物受撞击则完全分解为氮气和氢气。4.30 g该氢化物受撞击后产生的气体在标准状况下的体积为________L。
式为________。该氢化物受撞击则完全分解为氮气和氢气。4.30 g该氢化物受撞击后产生的气体在标准状况下的体积为________L。
(2)联氨和四氧化二氮可用作火箭推进剂,联氨是燃料,四氧化二氮做氧化剂,反应产物是氮气和水。由联氨和四氧化二氮组成的火箭推进剂完全反应生成72.0 kg水,则推进剂中联氨的质量________。
(3)氨的水溶液可用于吸收NO与NO2混合气体,反应方程式为6NO+ 4NH3===5N2+6H2O 6NO2+ 8NH3===7N2+12H2O。NO与NO2混合气体180 mol被8.90×103g氨水(质量分数0.300)完全吸收,产生156 mol氮气。吸收后氨水密度为0.980 g/cm3。则①该混合气体中NO与NO2的体积比为________,②吸收后氨水的物质的量浓度________(答案保留1位小数)。
解析:(1)n(N)=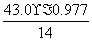 =3、n(H)=
=3、n(H)=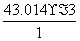 =1,因此化学式为HN3。 2HN3===H2+3N2,4.30 g HN3参加反应生成0.2 mol混合气体,标准状况下的体积为4.48 L。(2)2N2H4+N2O4===3N2+4H2O, 但当反应生成72.0 kg水时,参加反应的联氨的质量为,m(N2H4)=
=1,因此化学式为HN3。 2HN3===H2+3N2,4.30 g HN3参加反应生成0.2 mol混合气体,标准状况下的体积为4.48 L。(2)2N2H4+N2O4===3N2+4H2O, 但当反应生成72.0 kg水时,参加反应的联氨的质量为,m(N2H4)=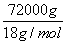 ×0.5×32 g/mol=64 000 g=64 kg。(3)设一氧化氮、二氧化氮的物质的量分别为X、Y,根据反应方程式和题干得出
×0.5×32 g/mol=64 000 g=64 kg。(3)设一氧化氮、二氧化氮的物质的量分别为X、Y,根据反应方程式和题干得出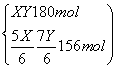 解得X=162 mol,Y=18 mol,相同条件下体积之比等于物质的量之比
解得X=162 mol,Y=18 mol,相同条件下体积之比等于物质的量之比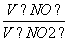 =
=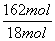 =
=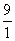 。参加反应的氨气的物质的量为
。参加反应的氨气的物质的量为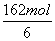 ×4+
×4+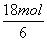 ×8=132 mol,完全反应后氨气的物质的量为
×8=132 mol,完全反应后氨气的物质的量为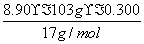 -132 mol=25 mol,完全反应后溶液的体积为
-132 mol=25 mol,完全反应后溶液的体积为
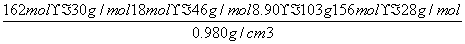 ×10-3L/cm3=10.428 L,c(NH3)=
×10-3L/cm3=10.428 L,c(NH3)=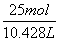 =2.4 mol/L。
=2.4 mol/L。
答案:(1)HN3 4.48 (2)64 kg
(3)9∶1 2.4 mol/L

 阅读快车系列答案
阅读快车系列答案 数为3NA
数为3NA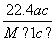 L B.
L B.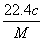 L
L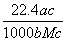 L D.
L D.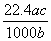 L
L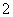 、②—NH2、③Br-、④OH-、⑤—NO2、⑥—OH、⑦NO2、⑧CH
、②—NH2、③Br-、④OH-、⑤—NO2、⑥—OH、⑦NO2、⑧CH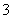 、⑨—CH3
、⑨—CH3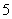 结合生成有机物分子的微粒有_____________________________
结合生成有机物分子的微粒有_____________________________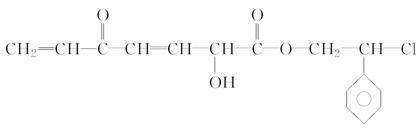
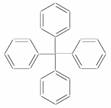 的分子,对该分子的描述不正确的是
的分子,对该分子的描述不正确的是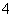
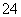 、AlO
、AlO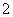
 、SO
、SO