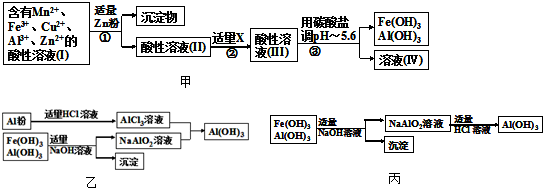
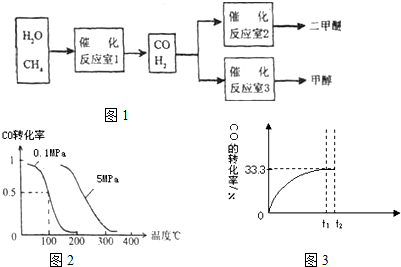
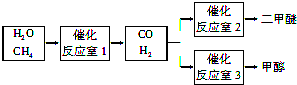
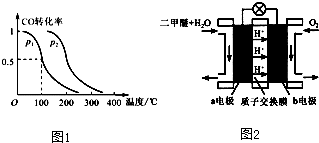
题目内容
(1)在一定条件下,21.6gA单原子单质与1.20molCl2完全反应,生成0.800molACl x,则x=
(2)写出H2SO4的电离方程式
3
3
,A的摩尔质量为27g?mol-1
27g?mol-1
.(2)写出H2SO4的电离方程式
H2SO4═2H++SO42-
H2SO4═2H++SO42-
,写出NaHCO3的电离方程式NaHCO3═Na++HCO3-
NaHCO3═Na++HCO3-
.分析:(1)根据氯原子守恒计算x的值,根据A原子守恒计算A的物质的量,再根据M=
计算A的摩尔质量;
(2)硫酸是强电解质,完全电离为氢离子与硫酸根离子;碳酸氢钠为强电解质,完全电离为钠离子与碳酸氢根离子.
| m |
| n |
(2)硫酸是强电解质,完全电离为氢离子与硫酸根离子;碳酸氢钠为强电解质,完全电离为钠离子与碳酸氢根离子.
解答:解:(1)根据氯原子守恒,有0.800mol×x=1.2mol×2,解得x=3,
根据A原子守恒可知,n(A)=n(AClx)=0.800mol,故M(A)=
=27g/mol,
故答案为:3;27g/mol;
(2)H2SO4的电离方程式为H2SO4═2H++SO42-,NaHCO3的电离方程式为:NaHCO3═Na++HCO3-,
故答案为:H2SO4═2H++SO42-;NaHCO3═Na++HCO3-.
根据A原子守恒可知,n(A)=n(AClx)=0.800mol,故M(A)=
| 21.6g |
| 0.800mol |
故答案为:3;27g/mol;
(2)H2SO4的电离方程式为H2SO4═2H++SO42-,NaHCO3的电离方程式为:NaHCO3═Na++HCO3-,
故答案为:H2SO4═2H++SO42-;NaHCO3═Na++HCO3-.
点评:本题考查质量守恒定律的有关计算、电离方程式的书写等,注意电离方程式应遵循电荷守恒、质量守恒定律,弱酸的酸式酸根不能拆开,题目难度不大.

练习册系列答案
相关题目