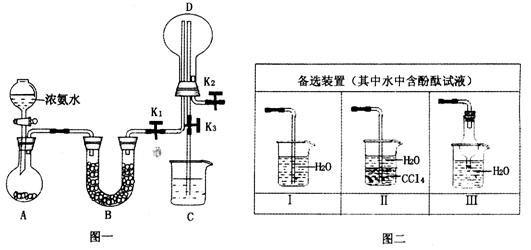
题目内容
某铵态氮肥由W、X、Y、Z等4种短周期元素组成,其中W的原子半径最小。
I.若Y、Z同主族,ZY2是形成酸雨的主要物质之一。
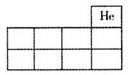
(1)将X、Y、Z的元素符号填在右图所示元素周期表(局部)中的相应位置上。
(2)X的最髙价氧化物对应水化物的稀溶液与铜反应的化学方程式为___ ___。
(3)一定条件下,1mol XW3气体与O2完全反应生成X元素的单质和液态水,放出382.8 kJ热量。该反应的热化学方程式为________________________。
II.若Z是形成化合物种类最多的元素。
(4)该氮肥的名称是______(填一种)。
(5)HR是含Z元素的一元酸。室温时,用0.250mol?L—1NaOH溶液滴定25.0 mL HR溶液时,溶液的pH变化情况如图所示。其中,a点表示两种物质恰好完全反应。
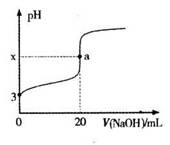
①右图中x______7(填“>”、“<”或“=”)。
②室温时,HR的电离常数Ka=______(填数值)。
I.若Y、Z同主族,ZY2是形成酸雨的主要物质之一。
(1)将X、Y、Z的元素符号填在右图所示元素周期表(局部)中的相应位置上。

(2)X的最髙价氧化物对应水化物的稀溶液与铜反应的化学方程式为___ ___。
(3)一定条件下,1mol XW3气体与O2完全反应生成X元素的单质和液态水,放出382.8 kJ热量。该反应的热化学方程式为________________________。
II.若Z是形成化合物种类最多的元素。
(4)该氮肥的名称是______(填一种)。
(5)HR是含Z元素的一元酸。室温时,用0.250mol?L—1NaOH溶液滴定25.0 mL HR溶液时,溶液的pH变化情况如图所示。其中,a点表示两种物质恰好完全反应。

①右图中x______7(填“>”、“<”或“=”)。
②室温时,HR的电离常数Ka=______(填数值)。
(14分)
(1)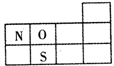 (2分)
(2分)
(2)3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O(3分)
(3)NH3(g)+3/4O2(g)=1/2N2(g)+3/2H2O(l) △H=—382.8kJ?mol—1,或4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H=—1531.2 kJ?mol—1(或其他合理答案,3分)
(4)碳酸氢铵(或其他合理答案)(2分)
(5)> 5.0×10—6(各2分,共4分)
(1)
 (2分)
(2分)(2)3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O(3分)
(3)NH3(g)+3/4O2(g)=1/2N2(g)+3/2H2O(l) △H=—382.8kJ?mol—1,或4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H=—1531.2 kJ?mol—1(或其他合理答案,3分)
(4)碳酸氢铵(或其他合理答案)(2分)
(5)> 5.0×10—6(各2分,共4分)
试题分析:(1)、NOx、SO2是形成酸雨的主要物质,O、S均为第VIA族,氮肥组成元素中原子半径最小的是H,由题意可知W、X、Y、Z分别为氢、氮、氧、硫,N位于第2周期第VA族,O位于第2周期第VIA族,S位于第3周期第VIA族;(2)、X是氮,其最高价氧化物对应水化物为HNO3,稀硝酸与铜反应生成硝酸铜、NO和H2O,该氧化还原反应方程式为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;(3)、X、W为氮和氢,XW3为NH3,由题意可知,NH3(g)+3/4O2(g)=1/2N2(g)+3/2H2O(l) △H=—382.8kJ?mol—1,或者为4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H=—1531.2 kJ?mol—1;(4)、形成化合物种类最多的元素为碳,则含有四种元素的氮肥为(NH4)2CO3、NH4HCO3或者碳酸铵和碳酸氢铵组成的混合物;(5)、①含有碳元素的一元酸由HCOOH、CH3COOH等,由于甲酸、乙酸是弱酸,则HR为一元弱酸,与氢氧化钠恰好完全中和时生成强碱弱酸盐,由水解规律可知溶液pH>7,则x>7;②室温时HR溶液的pH=3,则c(H+)=10—3mol?L—1,由于HR+NaOH=NaR+H2O中反应物的系数之比等于物质的量之比,则c(HR)=0.250mol?L—1×0.02L÷0.025L=0.200mol?L—1,由于HR
 H++R—,则的起始浓度均为0,变化浓度和平衡浓度均为10—3mol?L—1,HR的变化浓度为10—3mol?L—1,平衡浓度为0.200mol?L—1—10—3mol?L—1≈0.200mol?L—1,则HR的电离常数Ka=c(H+)?c(R—)/c(HR)=
H++R—,则的起始浓度均为0,变化浓度和平衡浓度均为10—3mol?L—1,HR的变化浓度为10—3mol?L—1,平衡浓度为0.200mol?L—1—10—3mol?L—1≈0.200mol?L—1,则HR的电离常数Ka=c(H+)?c(R—)/c(HR)=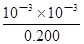 = 5.0×10—6。
= 5.0×10—6。
练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目