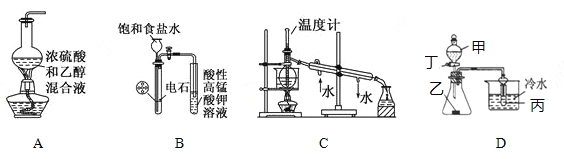
题目内容
【题目】原子序数依次增大的四种短周期主族元素A、B、C、D,A元素的一种同位素原子核内无中子;B元素形成的化合物种类最多;C、D元素同主族且最外层电子数为偶数。下列叙述正确的是
A. A元素的各同位素形成的双原子分子A2最多有3种
B. 化合物BC2的电子式为 ![]()
C. B、C、D三种元素的非金属性强弱顺序为C>D>B
D. 化合物A2C的沸点高于A2D是因为C—A键比D—A键稳定
【答案】D
【解析】A、原子核内没有中子的只有氢元素,氢元素有H、D、T三种同位素,形成的双原子分子有H2、HD、HT、D2、DT、T2等六种,A错误。B、形成化合物种类最多的是碳元素,所以B 为碳元素,C、D元素同主族且最外层电子数为偶数。短周期排在碳元素后面符合条件的只有氧元素和硫元素,所以化合物BC2是CO2,电子式是![]() ,B错误。C、C、O、S三种元素,C、O位于同一周期,C在前O在后,O的非金属性更强;O、S位于同一主族,O在上S在下,S 的非金属性更弱,因此C错误。D、化合物A2C是H2O,A2D是H2S,由于H2O分子间存在氢键,所以H2O的沸点更高,D正确。正确答案D。
,B错误。C、C、O、S三种元素,C、O位于同一周期,C在前O在后,O的非金属性更强;O、S位于同一主族,O在上S在下,S 的非金属性更弱,因此C错误。D、化合物A2C是H2O,A2D是H2S,由于H2O分子间存在氢键,所以H2O的沸点更高,D正确。正确答案D。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案【题目】Fe2O3具有广泛的用途。甲同学阅读有关资料得知:在高温下煅烧FeCO3可以得到Fe2O3。为了进一步验证此结论,他做了如下实验:
实验步骤 | 实验操作 |
Ⅰ | 取一定质暈的FeCO3固体置于 中,高温煅烧至质量不再减轻,冷却至室溫 |
Ⅱ | 取少量实验步骤Ⅰ所得固体放于一洁净的试管中,用足量的稀硫酸溶解 |
Ⅲ | 向实验步骤Ⅱ所得溶液中滴加KSCN溶液,溶液变红 |
由此甲同学得出结论:4FeCO3+O2![]() 2Fe2O3+4CO2
2Fe2O3+4CO2
(1)Ⅰ中横线处所需的化学仪器为______________________________________。
(2)写出实验步骤Ⅲ中发生反应的离子方程式_____________________________。
(3)乙同学提出不同看法:煅烧产物可能是Fe304,因为Fe304也可以溶于硫酸,且所得溶液中也含有Fe3+。于是乙同学对甲同学的实验步骤Ⅲ进行了补充改进:检验实验步骤Ⅱ所得溶液中是否含有Fe2+。他需要选择的试剂是___________________(填序号)。
a.氯水
b.氯水和KSCN溶液
c.酸性高锰酸钾溶液
(4)丙同学认为即使得到了乙同学预期的实验现象,也不能确定煅烧产物的成分。你认为丙同学持此看法的理由是______________________________________。
(5)丙同学进一步査阅资料得知,煅烧FeCO3的产物中的确含有+2价铁元素。于是他设计了另一种由FeCO3制取Fe2O3的方法:先向FeCO3中依次加入试剂:稀硫酸、_____________(填名称)和____________(填名称);再___________________(填操作名称),灼烧,即可得到Fe203。