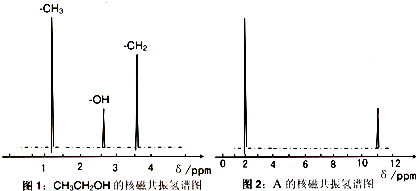
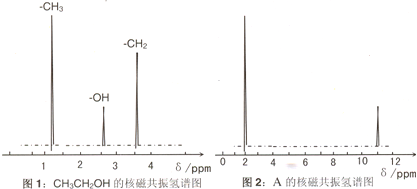
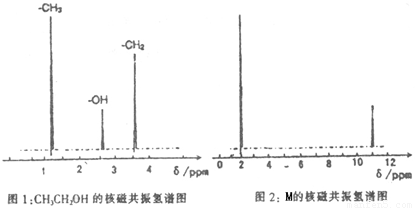
题目内容
(15分)淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图所示(加热、搅拌和仪器固定装置均已略去):
实验过程如下:
① 将1∶1的淀粉水乳液与少许硫酸(98%)加入烧杯中,水浴加热至85℃~90℃,保持30 min,然后逐渐将温度降至60℃左右;
② 将一定量的淀粉水解液加入三颈烧瓶中;
③ 控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2:1.5)溶液;
④ 反应3h左右,冷却,减压过滤后再重结晶得草酸晶体。
硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
请回答下列问题:
(1)实验①加入98%硫酸少许的目的是: 。
(2)冷凝水的进口是 (填a或b);实验中若混酸滴加过快,将导致草酸产量下降,其原因是 。
(3)检验淀粉是否水解完全所用的试剂为 。
(4)草酸重结晶的减压过滤操作中,除烧杯、玻璃棒外,还必须使用属于硅酸盐材料的仪器有 。
(5)当尾气中n(NO2):n(NO)=1:1时,过量的NaOH溶液能将NOx全部吸收,发生的化学反应为:NO2+NO+2NaOH=2NaNO2+H2O,若用含硫酸的母液来吸收氮氧化物,其优点是 、缺点是 。
(6)将产品在恒温箱内约90℃以下烘干至恒重,得到二水合草酸。用KMnO4标准溶液滴定,该反应的离子方程式为:2MnO4- + 5H2C2O4 + 6H+ = 2Mn2+ + 10CO2↑+ 8H2O
称取该样品0.12 g,加适量水完全溶解,然后用0.020 mol·L-1的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时溶液颜色由 变为 。滴定前后滴定管中的液面读数如图所示,则该草酸晶体样品中二水合草酸的质量分数为 。
(1) 加快淀粉水解的速度(或起到催化剂的作用)
(2) a 温度过高 、硝酸浓度过大,导致H2C2O4进一步被氧化
(3) 碘水或KI-I2 溶液
(4)布氏漏斗、吸滤瓶 (安全瓶、抽气泵不作为主要仪器)
(5) 优点:提高HNO3利用率(或循环使用氮氧化物) 缺点:NOx(或氮氧化物)吸收不完全
⑹无色 紫红色(或淡紫色) 84.0%
解析:(1)淀粉水解需要用浓硫酸作催化剂加快其水解速度。
(2)由于冷凝管是竖直放置的,由此从a进水冷凝效果最好。硝酸属于氧化性酸,浓度过大会进一步氧化草酸,导致产率降低。
(3)因为碘遇淀粉显蓝色,所以验证淀粉完全水解的方法是加入碘水,溶液不显蓝色。
(4)减压过滤时需要用的布氏漏斗、吸滤瓶。
(5)用含硫酸的母液来吸收氮氧化物,会生成硝酸而重复使用,但也会造成吸收不充分,造成环境污染。
(6)由方程式可知当反应恰好完成时,如果再滴入酸性高锰酸钾溶液,则溶液颜色将由无色变成红棕色。滴定前的读数是2.50ml,滴定后的读数是18.50ml,即消耗酸性高锰酸钾溶液的体积16.00ml,物质的量是3.2×10-4mol,因此草酸的物质的量是8.0×10-4mol,所以样品中二水合草酸的质量分数为![]()