题目内容
化合物A在一定条件下发生如下反应并建立平衡:
A(s)?2B(g)+C(g); 2C(g)?D(g)+3E(g).
这时C的浓度为0.01mol/L,E的浓度为0.015mol/L,则B的浓度为( )
A(s)?2B(g)+C(g); 2C(g)?D(g)+3E(g).
这时C的浓度为0.01mol/L,E的浓度为0.015mol/L,则B的浓度为( )
| A、0.02mol/L | B、0.025mol/L | C、0.03mol/L | D、0.04mol/L |
分析:E只有在最终产物中出现,当E的浓度为0.015mol/L,可以得出的浓度消耗的C的浓度,根据末态时C的浓度进而可以计算第一步化学反应生成的全部C的浓度.
解答:解:E只有在最终产物中出现,当E的浓度为0.015mol/L,可以得出的浓度消耗的C的浓度是0.05mol/L,根据末态时C的浓度是0.01mol/L,进而可以计算第一步化学反应生成的全部C的浓度即为0.02mol/L,得出B的浓度是0.04mol/L,即
2C(g)?D(g)+3E(g)
0.01mol/L 0.005mol/L 0.015mol/L
A(s)?2B(g)+C(g)
0.04mol/L 0.02mol/L
故选D.
2C(g)?D(g)+3E(g)
0.01mol/L 0.005mol/L 0.015mol/L
A(s)?2B(g)+C(g)
0.04mol/L 0.02mol/L
故选D.
点评:本题涉及化学平衡的建立过程知识,注意E的浓度是解决问题的关键所在,难度不大.

练习册系列答案
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案
相关题目

 )和C.经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.
)和C.经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.


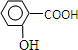


 ,为了研究X的结构,将化合物A在一定条件下水解只得到B(分子式为C8H8O3)和C(分子式为C7H6O3).C遇FeCl3水溶液显紫色,与NaHCO2溶液反应有CO2产生.请回答下列问题:
,为了研究X的结构,将化合物A在一定条件下水解只得到B(分子式为C8H8O3)和C(分子式为C7H6O3).C遇FeCl3水溶液显紫色,与NaHCO2溶液反应有CO2产生.请回答下列问题:
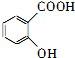
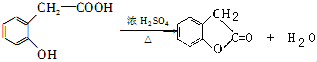
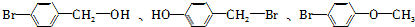
 )为主要原料制备
)为主要原料制备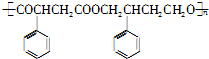 ?
?
 (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)





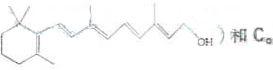
 :在研究其性能的过程中,发现结构片段X对化合物A的性能起了重要作用.为了研究X的结构,将化合物A在一定条件下水解只得到B(
:在研究其性能的过程中,发现结构片段X对化合物A的性能起了重要作用.为了研究X的结构,将化合物A在一定条件下水解只得到B( )和C.经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.
)和C.经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.
