题目内容
【题目】某研究性学习小组设计了一组实验来验证元素周期律. 用过氧化氢的水溶液和二氧化锰制备氧气,并将其通入到氢硫酸(H2S的水溶液)中.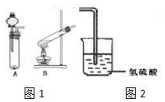
(1)过氧化氢的电子式:;
(2)从图1中选择氧气的制备装置 , 反应前需要的操作是:;
(3)该实验如何证明O的非金属性强于S(用化学方程式表示);
(4)你认为能证明Cl的非金属性强于S的是 a.S在常温下为固体而Cl2为气体 b.H2S不如HCl稳定
c.H2SO3的酸性弱于HClO3 d.S与H2化合不如Cl2与H2化合剧烈.
【答案】
(1)![]()
(2)A;检验装置气密性
(3)2H2S+O2=2S↓+2H2O
(4)bd
【解析】解:(1)过氧化氢中H、O原子之间共用一对电子,O、O原子之间共用一对电子,所以双氧水的电子式为 ![]() ,所以答案是:
,所以答案是: ![]() ;(2)过氧化氢的水溶液呈液态,二氧化锰为固态,所以该实验发生装置应该选取固液混合不加热型装置,应该选取A装置;该装置在实验前必须检验装置的气密性,否则可能得不到气体,所以答案是:A;检验装置气密性;(3)元素的非金属性越强,其单质的氧化性越强,所以只要氯气能氧化硫化氢得到硫单质就能证明氯元素氧化性大于硫元素,反应方程式为2H2S+O2=2S↓+2H2O, 所以答案是:2H2S+O2=2S↓+2H2O;(4)元素的非金属性越强,其单质的氧化性越强,其气态氢化物的稳定性越强,其单质与氢气化合越容易,其最高价氧化物的水化物酸性越强,所以符合条件的为bd,所以答案是:bd.
;(2)过氧化氢的水溶液呈液态,二氧化锰为固态,所以该实验发生装置应该选取固液混合不加热型装置,应该选取A装置;该装置在实验前必须检验装置的气密性,否则可能得不到气体,所以答案是:A;检验装置气密性;(3)元素的非金属性越强,其单质的氧化性越强,所以只要氯气能氧化硫化氢得到硫单质就能证明氯元素氧化性大于硫元素,反应方程式为2H2S+O2=2S↓+2H2O, 所以答案是:2H2S+O2=2S↓+2H2O;(4)元素的非金属性越强,其单质的氧化性越强,其气态氢化物的稳定性越强,其单质与氢气化合越容易,其最高价氧化物的水化物酸性越强,所以符合条件的为bd,所以答案是:bd.
【考点精析】本题主要考查了非金属在元素周期表中的位置及其性质递变的规律的相关知识点,需要掌握在目前已知的112种元素中,非金属元素有22种,除H外非金属元素都位于周期表的右上方(H在左上方).F是非金属性最强的元素才能正确解答此题.

 阅读快车系列答案
阅读快车系列答案