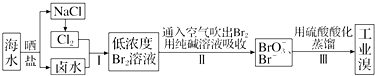
题目内容
5.下列说法正确的是( )| A. | 硅在常温下可以和氢气发生反应 | |
| B. | 硅是构成矿物和岩石的主要元素,硅在地壳中的含量最高 | |
| C. | 硅和任何酸都不反应 | |
| D. | 硅在电子工业上是重要的半导体材料 |
分析 A.硅性质稳定常温下与氢气不反应;
B.氧在地壳中的含量最高;
C.硅和HF反应;
D.硅导电性介于导体与绝缘体之间.
解答 解:A.硅在常温下和氢气不发生反应,故A错误;
B.硅是构成矿物和岩石的主要元素,硅在地壳中的含量占第二位,故B错误;
C.硅和HF反应生成四氟化硅,与其他酸不反应,故C错误;
D.硅导电性介于导体与绝缘体之间,是良好的半导体材料,故D正确;
故选:D.
点评 本题考查了硅的性质和用途,性质决定用途,熟悉硅的化学性质、物理性质是解题关键,注意硅在自然界中存在形态及含量,题目难度不大.

练习册系列答案
相关题目
12.用NA代表阿伏加德罗常数,下列叙述正确的是( )
| A. | 由CO2和O2组成的混合物共有NA个分子,其中的氧原子数为2NA | |
| B. | 62gNa2O溶于水,所得溶液中含有的O2-为NA | |
| C. | 0.5 mol•L-1的Ba(OH)2溶液中OH-的数目为NA | |
| D. | 在常温常压下,2.24L氨气中所含的分子总数为0.1NA |
13.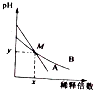 室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示,下列说法正确的是( )
室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示,下列说法正确的是( )
 室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示,下列说法正确的是( )
室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示,下列说法正确的是( )| A. | 稀释前,c(A)=10c(B) | |
| B. | 在M点,A、B两种碱溶液中阳离子的物质的量浓度相等 | |
| C. | 稀释前,A溶液中由水电离出的OH-的浓度大于10-7mol/L | |
| D. | 由图可知,A为强碱,B为弱碱 |
20.运用相关化学知识进行判断,下列结论正确的是( )
| A. | 铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸 | |
| B. | NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中 | |
| C. | 过氧化钠是强氧化剂,能氧化二氧化碳,因此过氧化钠可作呼吸面具中的供氧剂 | |
| D. | 增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 |
10.用NA表示阿伏加德罗常数,则下列说法正确是( )
| A. | 常温常压下,11.2L CH4中含有的氢原子数为2NA | |
| B. | 11.2 L CO2与8.5 g NH3所含分子数相等 | |
| C. | 常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA | |
| D. | 常温下,1L 0.1mol/L MgCl2溶液中含Cl- 数为0.1NA |
17.1.5mol乙烯与足量氯气发生完全加成反应,消耗氯气的物质的量为( )
| A. | 3mol | B. | 1.5mol | C. | 2mol | D. | 4mol |
14.下列与生产、生活相关的化学知识描述正确的是( )
| A. | 使用高效低毒的农药,既能提高作物产量,又能降低农药残留量 | |
| B. | 食品包装袋中常放入生石灰作为抗氧化剂,防止食品变质 | |
| C. | 水瓶胆中的水垢可用饱和食盐水清洗 | |
| D. | 明矾可用于净水,也可用于淡化海水 |
15.同温同压下,相同体积的氧气和氨气,可以肯定的是( )
| A. | 质量相等 | B. | 物质的量相等 | ||
| C. | 都含有6.02×1023个分子 | D. | 电子数相等 |