题目内容
13.Na2FeO4和Na2O2溶于水都能释放出能使带火星木条复燃的气体,在一定条件下,23.4gNa2O2与5.6g铁粉恰好完全反应生成Na2FeO4和12.4gA.已知A由两种元素组成,原子个数比为2:1,且能与水反应,反应后溶液呈碱性.(1)A的化学式为Na2O
(2)在Na2O2与铁粉的反应中,若消耗5.6g铁粉,则被还原的元素的质量是9.6g
(3)已知Na2FeO4溶于水产生气体的同时还生成红褐色胶体,写出发生反应的化学方程式:4Na2FeO4+10H2O=8NaOH+4Fe(OH)3+3O2
(4)铁粉和化合物Na2FeO4在高温下可能(填“可能”或“不能”)发生氧化还原反应,判断理由是可能;金属铁中Fe元素是零价,具有还原性,Na2FeO4中铁元素的化合价是+6价,强氧化剂,二者可以发生氧化还原反应.
分析 (1)23.4gNa2O2与5.6g铁粉恰好完全反应生成Na2FeO4和12.4gA,根据m=nM计算各物质的物质的量,根据质量守恒以及化学方程式的系数之比等于各物质的物质的量之比,得到A的化学式;
(2)Na2O2与铁粉的反应中,化合价降低元素在反应中被还原;
(3)Na2FeO4溶于水产生气体的同时还生成红褐色氢氧化铁胶体,根据元素守恒来配平、书写方程式;
(4)根据金属铁以及Na2FeO4中铁元素的化合价结合氧化还原反应中的规律知识来回答.
解答 解:(1)23.4g即0.3molNa2O2与5.6g即0.1mol铁粉恰好完全反应生成Na2FeO4和12.4gA,根据质量守恒,得到的Na2FeO4的质量是:23.4g+5.6g-12.4g=16.6g,物质的量是$\frac{16.6g}{166g/mol}$=0.1mol,所以反应中,Na2O2、Fe、Na2FeO4的系数分别是3、1、1,根据钠元素守恒,由两种元素组成,原子个数比为2:1,所以A的系数是2,A是Na2O,即A的化学式Na2O,故答案为:Na2O.
(2)Na2O2与铁粉的反应中:3Na2O2+Fe=Na2FeO4+2Na2O,化合价降低的O元素在反应中被还原,参加反应的过氧化钠的物质的量n=$\frac{23.4g}{78g/mol}$=0.3mol,所以被还原的元素的质量是0.3mol×2×16g/mol=9.6g,故答案为:9.6g;
(3)Na2FeO4溶于水产生气体的同时还生成红褐色氢氧化铁胶体,根据元素守恒:反应前有钠、氧、氢元素,因此反应后可能生成氢氧化钠,得到方程式为:4Na2FeO4+10H2O=8NaOH+4Fe(OH)3+3O2;故答案为:4Na2FeO4+10H2O=8NaOH+4Fe(OH)3+3O2;
(4)金属铁中Fe元素是零价,具有还原性,Na2FeO4中铁元素的化合价是+6价,强氧化剂,结合氧化还原反应中的规律,二者可以发生铁元素的归中反应,故答案为:可能;金属铁中Fe元素是零价,具有还原性,Na2FeO4中铁元素的化合价是+6价,强氧化剂,二者可以发生氧化还原反应.
点评 本题考查学生化学方程式的书写和计算以及氧化还原反应中的守恒思想和规律,注意知识的归纳和梳理是关键,难度中等.

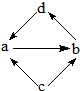 下列各组物质中,物质之间通过一步反应就能实现图所示转化的是
下列各组物质中,物质之间通过一步反应就能实现图所示转化的是| 编号 | a | b | c | d |
| ① | Na2O | Na2O2 | Na | NaOH |
| ② | Al2O3 | NaAlO2 | Al | Al(OH)3 |
| ③ | FeCl2 | FeC13 | Fe | CuCl2 |
| ④ | NO | NO2 | N2 | HNO3 |
| A. | ②③ | B. | ③④ | C. | ①②③ | D. | ①③④ |
| A. | 电解时,阳极反应为:Fe-2e-=Fe2+ | |
| B. | 电解过程中阴极能产生氢气 | |
| C. | 电解过程中,Cr2O72-在阳极放电 | |
| D. | 电解过程中,溶液中生成Cr(OH)3和Fe(OH)3沉淀 |
| A. | 漂白粉保存在密闭容器中 | B. | 新制氯水保存在棕色瓶中 | ||
| C. | AgBr保存在普通玻璃试剂瓶中 | D. | 往液溴中加少量水并密封保存 |
| A. | pH=4.0的番茄汁中c(H+)是pH=6.0的牛奶中c(H+)的100倍 | |
| B. | 强电解质溶液的导电性一定比弱电解质溶液的导电性强 | |
| C. | AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 | |
| D. | pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>c(CH3COO-) |
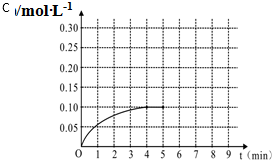 一定温度下,将0.4mol SO2和0.2mol O2放入固定容积为2L的密闭容器中,发生反应2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ/mol,反应中SO3的物质的量浓度的变化情况如图:
一定温度下,将0.4mol SO2和0.2mol O2放入固定容积为2L的密闭容器中,发生反应2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ/mol,反应中SO3的物质的量浓度的变化情况如图: