题目内容
(10分)(1)同温同压下,两种气体A和B的体积之比为2:1,质量之比为8:5,则A与B的密度之比为 ,摩尔质量之比为 。
(2)在标准状况下a. 6.72L CH4气体 b.3.01×1023个HCl气体分子 c.13.6g H2S气体 d.0.2molNH3,下列对这四种气体的关系从大到小的排列是(用上述序号表示)
①四种气体的物质的量 ,
②标准状况下四种气体的体积 ,
③四种气体的质量 。
【答案】
(10分)(1) 4:5 ; 4:5 (2)① b>c>a>d ② b>c>a>d ③ b>c>a>d (每空2分)
【解析】考查物质的量的有关计算。
(1)根据阿伏加德罗定律可知,气体的体积之比是气体的物质的量之比,所以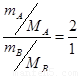 ,解得
,解得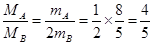 。又因为在相同条件下,气体的密度之比是气体的摩尔质量之比,所以二者的密度之比也是4︰5。
。又因为在相同条件下,气体的密度之比是气体的摩尔质量之比,所以二者的密度之比也是4︰5。
(2)标准状况下 6.72L CH4气体的物质的量是0.3mol,质量是4.8g;3.01×1023个HCl气体分子的物质的量是0.5mol,质量是18.25g;13.6g H2S气体的物质的量是13.6g÷34g/mol=0.4mol;0.2mol氨气的质量是3.4g,所以
①四种气体的物质的量从大到小的排列是b>c>a>d。
②标准状况下四种气体的体积从大到小的排列是b>c>a>d。
③四种气体的质量从大到小的排列是 b>c>a>d。

练习册系列答案
相关题目