题目内容
1.在Cl-和CrO42-离子浓度都是0.100mol•L-1的混合溶液中逐滴加入AgNO3溶液(忽略体积改变)时,问AgCl和Ag2CrO4哪一种先沉淀?当Ag2CrO4开始沉淀时,溶液中Cl-离子浓度是多少?已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12.
分析 析出沉淀时,AgCl溶液中c(Ag+)=$\frac{Ksp(AgCl)}{c(C{l}^{-})}$=$\frac{1.56×1{0}^{-10}}{0.1}$mol/L,Ag2CrO4溶液中c(Ag+)=$\sqrt{\frac{Ksp(A{g}_{2}Cr{O}_{4})}{c(Cr{O}_{4}^{2-})}}$=$\sqrt{\frac{9.0×1{0}^{-12}}{0.1}}$mol/L,c(Ag+)越小,先生成沉淀.
解答 解:析出沉淀时,AgCl溶液中c(Ag+)=$\frac{Ksp(AgCl)}{c(C{l}^{-})}$=$\frac{1.56×1{0}^{-10}}{0.1}$=1.56×10-9mol/L,Ag2CrO4溶液中c(Ag+)=$\sqrt{\frac{Ksp(A{g}_{2}Cr{O}_{4})}{c(Cr{O}_{4}^{2-})}}$=$\sqrt{\frac{9.0×1{0}^{-12}}{0.1}}$=3×10-5.5mol/L;c(Ag+)越小,故AgCl先出现沉淀;
当Ag2CrO4开始沉淀时,溶液中Cl-离子浓度c(Cl-)=$\frac{Ksp(AgCl)}{c(A{g}^{+})}$=$\frac{1.56×1{0}^{-10}}{3×1{0}^{-5.5}}$=5.16×10-5.5mol/L;
答:AgCl先出现沉淀;氯离子浓度为5.16×10-5.5mol/L.
点评 本题考查难溶电解质的溶解平衡问题,题目难度中等,注意根据溶解度判断生成沉淀的先后顺序,组成不相似的物质,不能直接根据溶度积判断.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
11.下列关于实验基本操作的叙述正确的是( )
| A. | 使用分液漏斗和容量瓶时,首先要洗净 | |
| B. | 蒸馏实验中,要在烧瓶中加入几粒沸石或碎瓷片,以防止液体暴沸 | |
| C. | 用蒸发皿进行加热蒸发时,一定要垫石棉网 | |
| D. | 向试管中加液体时,胶头滴管紧贴试管内壁 |
16.合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料.从天然气获得合成气过程中可能发生的反应有:
①CH4(g)+H2O(g)?CO(g)+3H2(g)△H1=+206.1kJ/mol
②CH4(g)+CO2(g)?2CO(g)+2H2(g)△H2=+247.3kJ/mol
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=c/mol•L-1
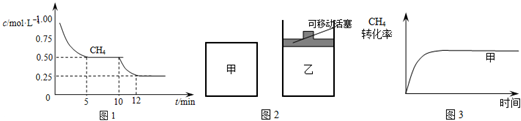
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示.反应进行的前5min内,v(H2)=0.3mol/(L.min);10min时,改变的外界条件可能是降低温度.
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等.在相同温度下发生反应②,并维持反应过程中温度不变.已知甲容器中CH4的转化率随时间变化的图象如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图象.
(3)800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
此时反应③中正反应速率大于逆反应速率(大于、小于、等于)
①CH4(g)+H2O(g)?CO(g)+3H2(g)△H1=+206.1kJ/mol
②CH4(g)+CO2(g)?2CO(g)+2H2(g)△H2=+247.3kJ/mol
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=c/mol•L-1

(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示.反应进行的前5min内,v(H2)=0.3mol/(L.min);10min时,改变的外界条件可能是降低温度.
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等.在相同温度下发生反应②,并维持反应过程中温度不变.已知甲容器中CH4的转化率随时间变化的图象如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图象.
(3)800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
6.下列事实不能用有机物分子内基团间的相互作用解释的是( )
| A. | 苯在50℃~60℃时发生硝化反应而甲苯在30℃时即可 | |
| B. | 苯酚能跟NaOH溶液反应而乙醇不能 | |
| C. | 甲苯能使KMnO4酸性溶液褪色而乙烷不能 | |
| D. | 乙烯能发生加成反应而乙烷不能 |
13.化学与社会生活密切相关,下列说法不正确的是( )
| A. | 化石燃料燃烧和工业废气中的氮氧化物均是导致“雾霾天气”的元凶 | |
| B. | 天津港爆炸事件中可知,当电石、钠、氰化钠等物品遇到明火时,应迅速用水浇灭 | |
| C. | 新发现一种固态碳,外形似海绵,密度小,有磁性,其与金刚石的关系是同素异形体 | |
| D. | 炒菜时,加一点酒和醋能使菜味可口,原因是有酯类物质生成 |
10.用NA表示阿佛加德罗常数,下列说法正确的是( )
| A. | 标准状况下,2.24L水所含的分子数为0.1NA | |
| B. | 常温常压下,1.6gO2和O3混合气体中原子总数为0.1NA | |
| C. | 0.3mol/L的BaCl2溶液中含Ba2+数目为0.3NA | |
| D. | 1mol氯气参加氧化还原反应,转移的电子数一定为2NA |
 光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成.
光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成.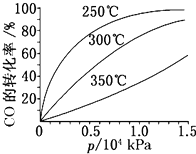 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.