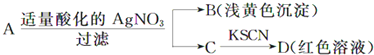
题目内容
【题目】图中X为电源,Y为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色斑向d端扩散。
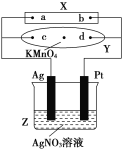
(1)Y中总反应的化学方程式为__________________,滤纸上c点附近会变________色。
(2)电解一段时间后,产生280 mL的气体(标准状况下),此时溶液的体积为500 mL,假设溶液中还有AgNO3存在,则Z中溶液的pH是________,需加入________g的________可使溶液复原。
【答案】2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑红15.8Ag2O
2NaOH+H2↑+Cl2↑红15.8Ag2O
【解析】
紫红色斑即MnO![]() 向d端扩散,根据阴离子向阳极移动的原理,可知d端为阳极,即b为正极,a为负极,c为阴极,据此分析可得结论。
向d端扩散,根据阴离子向阳极移动的原理,可知d端为阳极,即b为正极,a为负极,c为阴极,据此分析可得结论。
(1)NaCl溶液中H+放电,产生OH-,c点附近会变红色,故答案为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑、红;(2)电解AgNO3溶液时,Pt为阳极,溶液中的OH-放电:4OH--4e-===O2↑+2H2O,当有280 mL即0.012 5 mol的气体生成时,转移0.05 mol的电子,溶液中产生n(H+)=0.05 mol,即pH=1;Ag为阴极,溶液中的Ag+得电子,生成银0.05 mol。脱离体系的是银元素和氧元素,且n(Ag)∶n(O)=2∶1,所以可以加入0.025 mol 的Ag2O或Ag2CO3,则需要加入Ag2O的质量=0.025mol×232g/mol=5.8g,故答案为: 1、5.8、Ag2O。
2NaOH+H2↑+Cl2↑、红;(2)电解AgNO3溶液时,Pt为阳极,溶液中的OH-放电:4OH--4e-===O2↑+2H2O,当有280 mL即0.012 5 mol的气体生成时,转移0.05 mol的电子,溶液中产生n(H+)=0.05 mol,即pH=1;Ag为阴极,溶液中的Ag+得电子,生成银0.05 mol。脱离体系的是银元素和氧元素,且n(Ag)∶n(O)=2∶1,所以可以加入0.025 mol 的Ag2O或Ag2CO3,则需要加入Ag2O的质量=0.025mol×232g/mol=5.8g,故答案为: 1、5.8、Ag2O。

【题目】实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)K2FeO4作为高效、多功能水处理剂的原因是______________________________。
(2)制备K2FeO4(夹持装置略)
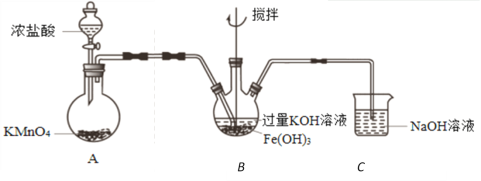
①A为氯气发生装置。A中反应方程式是_____________________________。
②该装置有明显不合理设计,如何改进?____________________________。
③改进后,B中得到紫色固体和溶液。B中Cl2发生的反应有3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O,另外还有____________________________。
(3)探究K2FeO4的性质(改进后的实验)
①取B中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
方案Ⅱ | 用KOH溶液充分洗涤B中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
a.由方案Ⅰ中溶液变红可知a中含有______离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由_________________________产生(用方程式表示)。
b.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是______________。
②根据K2FeO4的制备实验和方案Ⅱ实验表明Cl2和![]() 的氧化性强弱关系相反,原因是_____________。
的氧化性强弱关系相反,原因是_____________。