题目内容
【题目】25℃时,向盛有50 mL pH=2的HA溶液的绝热容器中加入pH=13的NaOH溶液,实验测得加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如下图所示。下列叙述正确的是

A. HA溶液的物质的量浓度为0.01 mol·L-1
B. b→c的过程中,温度降低的原因是溶液中发生了吸热反应
C. a→b的过程中,混合溶液中可能存在:c(A-)=c(Na+)
D. 25℃时,HA的电离常数K约为1.25×10-2
【答案】C
【解析】
A.根据温度变化分析,该反应在加入40mL氢氧化钠时完全反应,根据方程式分析,该酸的浓度为0.1mol/L×40mL/50mL=0.08mol/L,其pH为2,说明该酸为弱酸,故错误;
B. b→c的过程中,氢氧化钠溶液对溶液其冷却作用,故错误;
C. b点,HA与NaOH恰好完全反应得到NaA溶液,NaA溶液呈碱性,a→b的过程中,溶液从酸性逐渐变为碱性,混合溶液中若c(A-)=c(Na+),则根据电荷守恒分析,可以推知氢离子和氢氧根离子浓度相等,则溶液为中性,有可能,故正确;
D. 25℃时,从pH=2分析,HA的电离常数K约为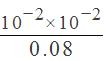 =1.25×10-3,故错误。
=1.25×10-3,故错误。
故选C。

练习册系列答案
相关题目
【题目】下表中金属难与表中其他金属形成二元合金的是( )
Fe | Cu | Zn | Ag | Au | W | |
熔点 | 1535 | 1083 | 419.5 | 962 | 1064 | 3410 |
沸点 | 3000 | 2595 | 907 | 2212 | 2707 | 5627 |
A.Cu、FeB.Fe、AuC.Zn、WD.Cu、Ag