题目内容
(17分)随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题。
(1)汽车尾气的大量排放是造成空气污染的重要因素之一,发展燃料电池汽车可以有效地解决上述问题。直接甲醇燃料电池(DMFC)不会产生有害产物,能量转换效率比内燃机要高2~3倍,电池结构如图所示,c处通入的物质为为______,外电路中电子从______到______(填“A”或“B”)移动,写出电池负极的电极反应方程式 
(2)工业废水中常含有一定量的Cr2O72-,会对人类及生态系统产生很大损害,电解法是处理铬污染的常用方法。该法用Fe做电极电解含Cr2O72-的酸性废水,电解时,在阴极上有大量气泡生成,并产生Cr(OH)3、Fe(0H)3沉淀。
①反应中,1molCr2O72-完全生成Cr(OH)3沉淀,外电路通过电子的物质的量为_________ mol。
②常温下,Cr(OH)3的溶度积 ,当Cr3+浓度小于10
,当Cr3+浓度小于10 mol
mol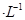 时可认为完全沉淀,电解完全后,测得溶液的pH=6,则该溶液过滤后为___________(填“能”或“否”)直接排放。
时可认为完全沉淀,电解完全后,测得溶液的pH=6,则该溶液过滤后为___________(填“能”或“否”)直接排放。
(3)含氨废水易引发水体富营养化。向NH4Cl溶液中加入少量NaOH固体,溶液中 ________(填“增大”“减小”或“不变”);25
________(填“增大”“减小”或“不变”);25 时,NH3?H2O的电离平衡常数
时,NH3?H2O的电离平衡常数 ,该温度下,1mol
,该温度下,1mol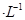 的NH4Cl溶液中
的NH4Cl溶液中
(17分)
(1)O2(2分) AB(2分) CH3OH—6e?+H2O=CO2+6H+(3分)
(2)①12(3分) ②能(2分)
(3)不变(2分) 2.36×10-5(3分)
解析试题分析:(1)电池内部阳离子向正极移动,根据题目所给示意图,H+向电解B移动,则电极B为正极,所以C处通入的物质为O2;外电路电子从负极向正极移动,所以从A到B移动;根据示意图可知电解液中含H+,负极上甲醇失去电子生成CO2和H+,所以电极方程式为:CH3OH—6e?+H2O=CO2+6H+
(2)①处理铬污染的原理是Fe做阳极发生反应:Fe—2e?=Fe2+,Cr2O72?氧化Fe2+,Cr2O72?被还原为Cr3+,根据化合价的变化,对应关系为:Cr2O72?~ 6Fe2+ ~6Fe,1molCr2O72-完全生成Cr(OH)3沉淀,阳极反应的Fe为6mol,外电路通过电子的物质的量为12mol。
②溶液的pH=6,则c(OH?)=10-8mol?L?1,带入溶度积公式可得:c(Cr3+)(10-8mol?L?1)3=10-32(mol?L?1)4,解得c(Cr3+)=10-8mol?L?1 < 10-5mol?L?1,能直接排放。
(3)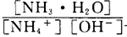 为NH4+水解平衡常数的倒数,NH4Cl溶液中加入少量NaOH,平衡常数不变,则该比值不变;根据盐类的水解与弱电解质电离的关系,水解平衡常数Kh=Kw/Kb=1.0×10-14mol2/L2÷(1.8×10-5mol?L?1)=5.56×10-10mol?L?1,则c(NH3?H2O)?c(H+)/c(NH4+)=5.56×10-10mol?L?1,因为c(NH3?H2O)≈c(H+),c(NH4+)≈1mol?L?1,带入计算式可得c(H+)=2.36×10-5mol?L?1。
为NH4+水解平衡常数的倒数,NH4Cl溶液中加入少量NaOH,平衡常数不变,则该比值不变;根据盐类的水解与弱电解质电离的关系,水解平衡常数Kh=Kw/Kb=1.0×10-14mol2/L2÷(1.8×10-5mol?L?1)=5.56×10-10mol?L?1,则c(NH3?H2O)?c(H+)/c(NH4+)=5.56×10-10mol?L?1,因为c(NH3?H2O)≈c(H+),c(NH4+)≈1mol?L?1,带入计算式可得c(H+)=2.36×10-5mol?L?1。
考点:本题考查原电池原理、电解池原理、水解平衡及其计算。

 阶梯计算系列答案
阶梯计算系列答案电离度表示电解质的相对强弱,电离度的定义:
α=(已电离的电解质分子数/溶液中原有电解质的总分子数)×100%。
已知25℃时几种物质(微粒)的电离度(溶液浓度均为0.1 mol·L-1)如下表:
| 编号 | 物质(微粒) | 电离度α |
| A | 硫酸溶液(第一步完全电离): 第二步 HSO4- H++SO42- H++SO42- | 10% |
| B | 硫酸氢钠溶液: HSO4- H++SO42 H++SO42 | 29% |
| C | 醋酸: CH3COOH CH3COO-+H+ CH3COO-+H+ | 1.33% |
| D | 盐酸: HCl=H++Cl- | 100% |
(1)25℃时,0.1 mol·L-1上述几种溶液中,c(H+)从大到小的顺序是 (填序号);
(2)25℃时,0.1 mol·L-1硫酸溶液中HSO4-的电离度小于相同温度下0.1 mol·L-1硫酸氢钠
溶液中HSO4-的电离度,其原因是 。
(3)醋酸的电离平衡常数K的表达式是 ,醋酸的电离平衡常数
K与电离度α的关系式为:K= (用含α的代数式表示)
酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法,其中溶液的pH变化是判断滴定终点的依据。
(1)为了准确绘制上图,在滴定开始时和________,滴液速度可以稍快一点,测试和记录pH的间隔可大些;当接近________时,滴液速度应该慢一些,尽量每滴一滴就测试一次。
(2)在图中A的pH范围使用的指示剂是____________;C的pH范围使用的指示剂是________________;D区域为________________。
(3)用0.1 032 mol·L-1的盐酸溶液滴定未知浓度的氢氧化钠溶液,重复三次的实验数据如下表所示:
| 实验序号 | 消耗0.1 032 mol·L-1的盐酸溶液的体积/mL | 待测氢氧化钠溶液的体积/mL |
| 1 | 28.84 | 25.00 |
| 2 | 27.83 | 25.00 |
| 3 | 27.85 | 25.00 |
则待测氢氧化钠的物质的量浓度是________mol·L-1。在上述滴定过程中,若滴定前滴定管下端尖嘴中有气泡,滴定后气泡消失,则测定结果将________(填“偏高”、“偏低”或“不影响”)。
(4)下列关于上述中和滴定过程中的操作正确的是________(填字母)。
A.用碱式滴定管量取未知浓度的烧碱溶液
B.滴定管和锥形瓶都必须用待盛放液润洗
C.滴定中始终注视锥形瓶中溶液颜色变化
D.锥形瓶中的待测液可用量简量取
下列与金属腐蚀有关的说法正确的是( )
| A.图a中,插入海水中的铁棒越靠近底端腐蚀越严重 |
| B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小 |
| C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 |
| D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
 H+ + H2PO3-。亚磷酸与足量NaOH溶液反应,生和Na2HPO3。
H+ + H2PO3-。亚磷酸与足量NaOH溶液反应,生和Na2HPO3。
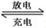 Fe+2NaCl,该电池放电时,正极反应式为 ________________ _____:
Fe+2NaCl,该电池放电时,正极反应式为 ________________ _____:
