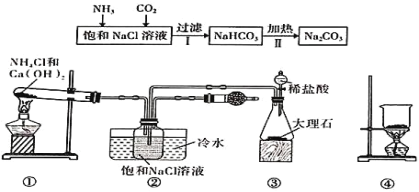
��Ŀ����
����Ŀ���ڻ�ѧ��Ӧ�У�ֻ�м�����������ƽ�������ߵö�ķ�Ӧ����ӷ�����ײʱ�ſ��ܷ�����ѧ��Ӧ����Щ���ӱ���Ϊ����ӡ�ʹ��ͨ���ӱ�ɻ���������ṩ������ȵ������л�ܣ��䵥λͨ����kJ��mol-1��ʾ��������۲���ͼ��Ȼ��ش����⡣

��1��ͼ����ʾ��Ӧ��_________(��������������������)��Ӧ���÷�Ӧ_____________(������Ҫ����������Ҫ��)���ȣ��÷�Ӧ����H =______________________(�ú�E1��E2�Ĵ���ʽ��ʾ)��
��2����֪�Ȼ�ѧ����ʽ��H2(g)�� O2(g) =![]() H2O(g) ��H =��241.8 kJ��mol-1���÷�Ӧ�Ļ��Ϊ167.2 kJ��mol-1�������淴Ӧ�Ļ��Ϊ____________________��
H2O(g) ��H =��241.8 kJ��mol-1���÷�Ӧ�Ļ��Ϊ167.2 kJ��mol-1�������淴Ӧ�Ļ��Ϊ____________________��
���𰸡����� ��Ҫ E2��E1 409.0 kJ�� mol��1
��������

��1���÷�Ӧ�з�Ӧ���������������������������������Ƿ��ȷ�Ӧ���÷�Ӧ����H=�������������-��Ӧ���������������H=E2��E1���ӷ�Ӧ�����ת��Ϊ����ӣ���Ҫ�������������Է�Ӧ��Ҫ���ȡ�
��2����ӦH2(g)��O2(g) =![]() H2O(g)Ϊ���ȷ�Ӧ���ӷ�Ӧ��ת��Ϊ������ų�241.8 kJ���������ӷ�Ӧ��ת��Ϊ���������167.2kJ�������������淴Ӧ�Ļ��Ϊ241.8+167.2=409.0 kJ�� mol��1��
H2O(g)Ϊ���ȷ�Ӧ���ӷ�Ӧ��ת��Ϊ������ų�241.8 kJ���������ӷ�Ӧ��ת��Ϊ���������167.2kJ�������������淴Ӧ�Ļ��Ϊ241.8+167.2=409.0 kJ�� mol��1��

 ÿ��10���ӿ�����������������ϵ�д�
ÿ��10���ӿ�����������������ϵ�д�