题目内容
(1)将金属A和金属B分别放入同浓度的稀硫酸中,均有气体产生.(2)将金属A和金属B相连后投入稀硫酸中,发现A被腐蚀,B没有.下列说法正确的是( )
分析:活动性强的金属易和酸发生置换反应生成氢气,将金属A和金属B分别放入同浓度的稀硫酸中,均有气体产生,说明金属A和金属B活动性大于氢;
在原电池中,较活泼的金属作负极,较不活泼的金属作正极,负极易被腐蚀,负极上失电子发生氧化反应,正极上得电子发生还原反应,根据题意知,所以这两种金属的活动性顺序是A>B,金属的金属性越强,其单质的还原性越强;
在原电池中,较活泼的金属作负极,较不活泼的金属作正极,负极易被腐蚀,负极上失电子发生氧化反应,正极上得电子发生还原反应,根据题意知,所以这两种金属的活动性顺序是A>B,金属的金属性越强,其单质的还原性越强;
解答:解:A.活动性强的金属易和酸发生置换反应生成氢气,在原电池中,较活泼的金属作负极,较不活泼的金属作正极,所以这两种金属的活动性顺序是A>B,故A错误;
B.活动性强的金属易和酸发生置换反应生成氢气,将金属A和金属B分别放入同浓度的稀硫酸中,均有气体产生,说明金属A和金属B活动性大于氢,故B错误;
C.金属的金属性越强,其单质的还原性越强,与酸反应越快,在(1)中,金属A的反应速率比金属B快,故C错误;
D.将金属A和金属B相连后投入稀硫酸中,发现A被腐蚀,为负极,金属B为正极,氢离子得到电子形成氢气,所以在(2)中,金属B表面上有气体产生,故D正确;
故选:D;
B.活动性强的金属易和酸发生置换反应生成氢气,将金属A和金属B分别放入同浓度的稀硫酸中,均有气体产生,说明金属A和金属B活动性大于氢,故B错误;
C.金属的金属性越强,其单质的还原性越强,与酸反应越快,在(1)中,金属A的反应速率比金属B快,故C错误;
D.将金属A和金属B相连后投入稀硫酸中,发现A被腐蚀,为负极,金属B为正极,氢离子得到电子形成氢气,所以在(2)中,金属B表面上有气体产生,故D正确;
故选:D;
点评:本题考查了金属的活动性顺序的判断,难度不大,需要注意的是在原电池中,较活泼的金属作负极,较不活泼的金属作正极.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
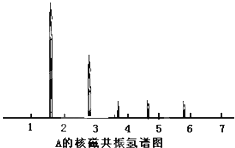 为测定某有机化合物A的结构,进行如下实验.
为测定某有机化合物A的结构,进行如下实验.