题目内容
2.用石墨作电极电解FeCl2与HCl的混合溶液,下列分析正确的是( )| A. | 阴极上的电极反应式为:2H2O+2e-═2OH-+H2↑ | |
| B. | 电解过程中,H+向阳极移动 | |
| C. | 阳极区溶液很快变黄色 | |
| D. | 电解过程中溶液pH减小 |
分析 用石墨作电极电解FeCl2与HCl的混合溶液,阴极上氧化性强的离子得电子,即氢离子得电子,阳极上还原性强的失电子,即亚铁离子失电子,据此分析.
解答 解:A.电解时,阴极上氧化性强的离子得电子,即氢离子得电子,则阴极上的电极反应式为2H++2e-═H2↑,故A错误;
B.电解时,H+在阴极得电子,即H+向阴极移动,故B错误;
C.阳极上还原性强的失电子,即亚铁离子失电子,阳极电极方程式为Fe2+-e-=Fe3+,Fe3+在溶液中显黄色,故C正确;
D.电解时,消耗氢离子,所以溶液的pH增大,故D错误.
故选C.
点评 本题考查了电解质溶液的混合电解,注意把握溶液中离子放电顺序、阴阳极的判断,题目难度中等,侧重于考查学生的分析能力和应用能力.

练习册系列答案
相关题目
8.下列条件下,两瓶气体所含原子数一定相等的是( )
| A. | 同体积,同密度的C2H4和C3H6 | B. | 同温度、同体积和H2和O2 | ||
| C. | 同质量、不同密度的N2和C2H4 | D. | 同压强、同体积的N2和CO |
15.下列物质中,不能使酸性KMnO4溶液褪色的物质是( )
①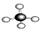 ②乙烯 ③CH3CH2OH ④CH2=CH-CH3 ⑤
②乙烯 ③CH3CH2OH ④CH2=CH-CH3 ⑤
①
 ②乙烯 ③CH3CH2OH ④CH2=CH-CH3 ⑤
②乙烯 ③CH3CH2OH ④CH2=CH-CH3 ⑤
| A. | ①⑤ | B. | ①③④⑤ | C. | ①④ | D. | ①③④ |
7.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 将0.5 mol NH4NO3溶于稀氨水中,溶液呈中性,溶液中NH4+的数目为0.5NA | |
| B. | 将0.2mol NH3充入密闭容器中,在一定条件下加热分解,生成N2的分子数为0.1NA | |
| C. | 足量的铜与50 mL 18 mol/L的浓硫酸在加热条件下反应时,转移的电子数为0.9NA | |
| D. | 标准状况下,8.96L平均相对分子质量为3.5g的H2与D2含有的中子数为0.3NA |
11.在指定的条件下,下列各组离子能大量共存的是( )
| A. | 使甲基橙变红的溶液中:Fe2+、Na+、I-、NH4+ | |
| B. | 强碱性溶液中:K+、Na+、ClO-、S2- | |
| C. | 1 mol•L-1 FeCl3溶液中:H+、Na+、SCN-、SO42- | |
| D. | 由H2O电离出的c(H+)=10-11mol/L溶液中:Na+、HCO3-、AlO2-、SO42- |
12.金刚烷胺是最早用于抑制流感病毒的抗病毒药,1998年才被批准用于流感病毒A型感染性疾病的治疗,其合成线路图如图所示.下列说法中正确的是( )


| A. | 金刚烷的分子式是C10H20 | B. | X的同分异构体可以是芳香化合物 | ||
| C. | 上述反应都属于取代反应 | D. | 金刚烷胺的一溴代物有两种 |
 某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.
某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.
 反应类型:加聚反应
反应类型:加聚反应