题目内容
9.在一定条件下,反应CO+NO2?CO2+NO,达到平衡后,降低温度,混和气体的颜色变浅.下列判断正确的是( )| A. | 正反应为吸热反应 | B. | 正反应为放热反应 | ||
| C. | CO的平衡转化率降低 | D. | 各物质的浓度不变 |
分析 反应CO+NO2?CO2+NO 中,只有NO2有颜色,降低温度导致混合气体的颜色变浅,说明二氧化氮气体浓度减小,平衡正向移动,正反应放热,据此分析.
解答 解:反应CO+NO2?CO2+NO 中,只有NO2有颜色,降低温度导致混合气体的颜色变浅,说明二氧化氮气体浓度减小,平衡正向移动,正反应放热,
A、正反应是放热反应,故A错误;
B、正反应是放热反应,故B正确;
C、平衡正向移动,CO转化率增大,故C错误;
D、混合气体颜色变浅,说明平衡正向移动,反应物浓度减小,生成物浓度增大,故D错误;
故选B.
点评 本题考查了化学平衡的移动,注意混合气体颜色不变可以作为平衡状态的标志,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.人们会利用纳米级(1-100nm,1nm=10-9m)微粒物质制造出更加优秀的材料和器件,使化学在材料、能源、环境和生命科学等领域发挥越来越重要的作用.将纳米级微粒物质溶解于液体溶剂中形成一种分散系,对该分散系及分散质颗粒的叙述中正确的是( )
| A. | 该分散系能发生丁达尔效应 | |
| B. | 该分散系为溶液 | |
| C. | 该分散系属于悬浊液 | |
| D. | 该分散系放置一段时间可能很快出现分层现象 |
20.工业合成氨反应是700K左右进行的,这主要原因是( )
| A. | 700K时此反应速率最快 | |
| B. | 700K时氨的平衡浓度最大 | |
| C. | 700K时氨的转化率最高 | |
| D. | 700K该反应的催化剂能发挥最大的作用 |
17.下列事实中能说明亚硝酸是弱电解质的是( )
| A. | 用HNO2溶液做导电试验,灯光较暗 | |
| B. | HNO2是共价化合物 | |
| C. | 亚硝酸不与氯化钠反应 | |
| D. | 常温下0.1mol/L亚硝酸溶液的氢离子约为0.01mol/L |
4.只用一种试剂就可将AgNO3、KSCN和H2SO4、NaOH四种无色溶液区分,这种试剂是( )
| A. | Fe(NO3)3溶液 | B. | FeCl2溶液 | C. | BaCl2溶液 | D. | FeCl3溶液 |
14.某温度下,浓度都是1mol•L-1的两种气体X2和Y2,在密闭容器中反应生成气体Z,经过t min后,测得物质的浓度分别为:[X2]=0.4mol•L-1,[Y2]=0.8mol•L-1,[Z]=0.4mol•L-1,则该反应的反应式可表示为( )
| A. | X2+2Y2?2XY2 | B. | 2X2+Y2?X2Y | C. | 3X2+Y2?2X3Y | D. | X2+3Y2?2XY3 |
1.把下列四种X溶液分别加入四个盛有10mL 2mol•L-1盐酸的烧杯中,均加水稀释到50mL,此时,X和盐酸缓慢地进行反应,其中反应速率最快的是( )
| A. | 10℃20mL3 mol•L-1的X溶液 | B. | 20℃30 mL 2 mol•L-1的X溶液 | ||
| C. | 20℃10 mL 4 mol•L-1的X溶液 | D. | 10℃10 mL 2 mol•L-1的X溶液 |
18.少量的金属钠长期暴露在空气中,它的最终产物是( )
| A. | NaOH | B. | NaHCO3 | C. | Na2CO3 | D. | Na2CO3•10H2O |
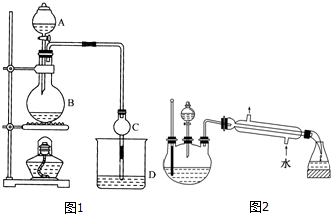
19.某课外小组设计的实验室制取乙酸乙酯的装置如图1所示,A中放有浓硫酸,B中放有乙醇(含180)、无水醋酸钠,D中放有含有酚酞饱和碳酸钠溶液.
已知①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H50H
②有关有机物的沸点:
请回答:
(1)浓硫酸的作用是制乙酸、催化剂、吸水剂;若用同位素180示踪法确定反应产物水分子中氧原子的提供者,写出能表示180位置的化学方程式:CH3COOH+CH3CH218OH CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.
(2)球形干燥管C的作用是防止倒吸、冷凝.反应结束后D中的现象是溶液分层,上层无色油体液体,下层溶液颜色变浅.
(3)上述实验中饱和碳酸钠溶液的作用是中和乙酸并吸收乙醇,减少乙酸乙酯的溶解.
(4)欲从D中得到乙酸乙酯的分离方法是分液;从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出乙醇;
(5)某化学课外小组设计了如图2所示的制取乙酸乙酯的装置(图中的铁架台、铁夹、加热装置已略去),与图1装置相比,此装置的主要优点有:(请写出两点):①增加了温度计,便于控制发生装置中反应液的温度,减少副产物的发生;②增加了冷凝装置,有利于收集产物乙酸乙酯.

已知①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H50H
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
(1)浓硫酸的作用是制乙酸、催化剂、吸水剂;若用同位素180示踪法确定反应产物水分子中氧原子的提供者,写出能表示180位置的化学方程式:CH3COOH+CH3CH218OH
 CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.(2)球形干燥管C的作用是防止倒吸、冷凝.反应结束后D中的现象是溶液分层,上层无色油体液体,下层溶液颜色变浅.
(3)上述实验中饱和碳酸钠溶液的作用是中和乙酸并吸收乙醇,减少乙酸乙酯的溶解.
(4)欲从D中得到乙酸乙酯的分离方法是分液;从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出乙醇;
(5)某化学课外小组设计了如图2所示的制取乙酸乙酯的装置(图中的铁架台、铁夹、加热装置已略去),与图1装置相比,此装置的主要优点有:(请写出两点):①增加了温度计,便于控制发生装置中反应液的温度,减少副产物的发生;②增加了冷凝装置,有利于收集产物乙酸乙酯.