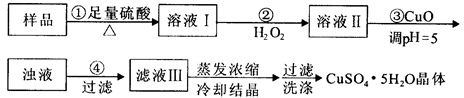
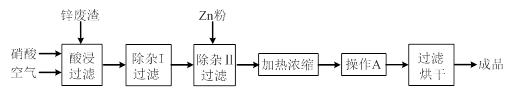题目内容
某化学研究性学习小组拟对一种焰火原料(由两种短周期的常见金属单质组成的合金粉末)进行探究。请完成下列探究报告。
【探究目的】探究该焰火原料的组成
【资料检索】①Mg2+检验方法:取2滴待检液,加入2滴2mol·L-1NaOH溶液,再加入1滴镁试剂(Ⅰ)染料(对硝基苯偶氮苯二酚)。若出现沉淀并吸附镁试剂(Ⅰ)染料呈天蓝色,表示待检液中含有Mg2+。Ag+、Cu2+、Fe3+、NH4+会妨碍Mg2+检出
②Mg(OH)2可溶于浓的氯化铵溶液,其他的常见不溶碱难溶于氯化铵
③很多合金是金属互化物,有确定的化学组成
【探究思路】①确定焰火原料所含金属种类;②测定焰火原料的化学式
【实验探究】
(1)甲同学进行了初步试验,实验步骤和实验现象如下。请填写下表。
(2)乙同学取甲第②组实验的溶液,加入镁试剂(Ⅰ)染料,得出合金中不含镁。
乙的结论________________(选填“正确”或“错误”)。判断理由为
(3)丙同学设计实验方案,确定焰火原料中的金属种类,实验记录如下。

由丙的实验记录可知,该焰火原料是由_______和_________两种金属组成的合金;实验中滤液加入足量
氢氧化钠溶液后需煮沸,煮沸的理由是______________________________。
(4)丁同学利用丙同学的结论,设计如下图所示的实验步骤,确定合金组成。
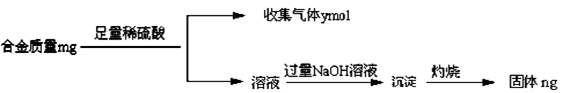
问题讨论:
①能确定合金组成的数据组有______________(填写选项字母);
A.m、n B.m、y C.n、y
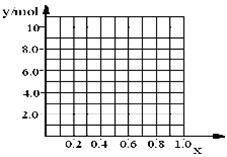
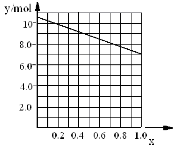
②若合金中相对原子质量较小的金属的物质的量分数为x,金属总物质的量为7mol,试在下图中作出y随x变化的曲线;
③当y=8.5mol时,该合金是一种金属互化物,其化学式为________________
【探究目的】探究该焰火原料的组成
【资料检索】①Mg2+检验方法:取2滴待检液,加入2滴2mol·L-1NaOH溶液,再加入1滴镁试剂(Ⅰ)染料(对硝基苯偶氮苯二酚)。若出现沉淀并吸附镁试剂(Ⅰ)染料呈天蓝色,表示待检液中含有Mg2+。Ag+、Cu2+、Fe3+、NH4+会妨碍Mg2+检出
②Mg(OH)2可溶于浓的氯化铵溶液,其他的常见不溶碱难溶于氯化铵
③很多合金是金属互化物,有确定的化学组成
【探究思路】①确定焰火原料所含金属种类;②测定焰火原料的化学式
【实验探究】
(1)甲同学进行了初步试验,实验步骤和实验现象如下。请填写下表。
| 试验序号 | 实 验 步 骤 | 实 验 现 象 | 结 论 |
| ① | 取少量该焰火原料加入冷水 | 无明显现象 | ________________ |
| ② | 取少量该焰火原料加入稀盐酸 | 完全溶解,有大量气体 | _________________ |
(2)乙同学取甲第②组实验的溶液,加入镁试剂(Ⅰ)染料,得出合金中不含镁。
乙的结论________________(选填“正确”或“错误”)。判断理由为
(3)丙同学设计实验方案,确定焰火原料中的金属种类,实验记录如下。

由丙的实验记录可知,该焰火原料是由_______和_________两种金属组成的合金;实验中滤液加入足量
氢氧化钠溶液后需煮沸,煮沸的理由是______________________________。
(4)丁同学利用丙同学的结论,设计如下图所示的实验步骤,确定合金组成。

问题讨论:
①能确定合金组成的数据组有______________(填写选项字母);
A.m、n B.m、y C.n、y
②若合金中相对原子质量较小的金属的物质的量分数为x,金属总物质的量为7mol,试在下图中作出y随x变化的曲线;

③当y=8.5mol时,该合金是一种金属互化物,其化学式为________________
(1)①不含锂(Li)、钠(Na)等活泼金属
②可能含铍(Be)、镁(Mg)、铝(Al)三种金属中的任意两种金属
(2)错误;由资料知,反应必须在碱性条件下进行
(3)铝(或Al);镁(或Mg)(顺序可互换);将NH4+转化为NH3,煮沸促进其逸出,防止NH4+干扰Mg2+检验
(4)①ABC
②见下图
③Mg4Al3
②可能含铍(Be)、镁(Mg)、铝(Al)三种金属中的任意两种金属
(2)错误;由资料知,反应必须在碱性条件下进行
(3)铝(或Al);镁(或Mg)(顺序可互换);将NH4+转化为NH3,煮沸促进其逸出,防止NH4+干扰Mg2+检验
(4)①ABC
②见下图

③Mg4Al3
试题分析:(1)①原料加入冷水无现象表明不含Li、Na等活泼金属;
②原料与盐酸反应产生气体表明含有能与盐酸反应的较活泼的金属,例如铍(Be)、镁(Mg)、铝(Al)三种金属中的任意两种金属。
(2)第②组实验所得的溶液含有过量盐酸,加入2滴NaOH溶液则不会产生沉淀,从而不能吸附镁试剂(I)染料呈天蓝色,所以不能检验不出Mg2+,要检验镁离子反应需要在解析条件下完成。
(3)合金能溶于盐酸,其溶液中滴加氨水生成白色沉淀。向白色沉淀中滴加过量的饱和氯化铵溶液,白色沉淀部分溶解,且剩余的白色沉淀既能和氢氧化钠溶液反应,也能和盐酸反应。因此根据Mg(OH)2可溶于浓的氯化铵溶液可知,该白色沉淀一定是由氢氧化镁和氢氧化铝组成的。由于Mg(OH)2可溶于浓的氯化铵溶液,因此用镁试剂(Ⅰ)染料检验Mg2+时要排除NH4+的干扰,所以滤液加入足量氢氧化钠溶液将NH4+转化为NH3,煮沸将氨气赶出,目的是防止NH4+干扰Mg2+的检验(或排除溶液中NH4+的干扰)。(4)①镁和铝都能与盐酸反应生成氢气,根据氢气的体积结合合金总质量可确定合金的组成。加入过量氢氧化钠得到的沉淀为氢氧化镁,灼烧后可得到氧化镁,根据氧化镁的质量可知镁的质量,则可知铝的质量,已知镁的质量和镁铝生成氢气的体积可知铝的质量,则A、B、C都可测定合金的组成,故答案为:A、B、C。
②若合金中相对原子质量较小的金属的物质的量分数为x,金属总物质的量为7mol,相对分子质量较小的为镁。若x=0,则全被为铝,7mol铝反应生成10.5mol氢气;如全被为镁,即x=7,则生成氢气7mol,所以图象为
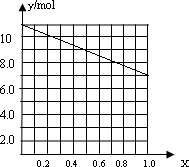 。
。③设合金中镁和铝的物质的量分别是a和b,则a+b=7mol、a+1.5b=8.5mol,解得a=4mol、b=3mol,所以合金的组成是Mg4Al3。

练习册系列答案
相关题目