��Ŀ����
����Ŀ�������£���0.10mol/LNaOH��Һ�ζ�20.00mL 0.10mol/LHA��Һ(�ζ�����ͼ)������˵����ȷ����
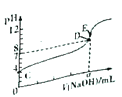
A. ��ͼ���Ա�ʾ��NaOH�ζ����������
B. ͼ��D��״̬ʱ��Һ���У�c(Na+)��c(A-)
C. �ﵽD��E״̬ʱ�����У�c(Na+)+c(H+)=c(A-)+c(OH-)
D. ��O<V(NaOH)<20.00mLʱ����Ӧ�����Һ�и�����Ũ���ɴ�С��˳���Ϊc(A-)> c(Na+)> c(H+)>c(OH-)
���𰸡�C
��������A������ͼ֪��HAδ������������ҺʱpH=3��HA��Ũ����0.1mol/L������HA�����ᣬ��������ǿ�ᣬ��A����B��ͼ��D����Һ�����ԣ����ݵ���غ�c(Na+)+c(H+)=c(A-)+c(OH-)����֪��ʱ��Һ��c(Na+)=c(A-)����B����C���ﵽD��E״̬ʱ����Һ�о����ڵ���غ�ʽc(Na+)+c(H+)=c(A-)+c(OH-)����C��ȷ��D����0mL��V��NaOH����20.00mLʱ�����������Һ�����ԣ�����c��H+����c��OH-��������������Ƶ������٣�����Һ��c��H+����c��Na+��������������Ƶ���ΪHA��һ�룬��c��Na+��=c��H+��������������Ƶ����϶�ʱ����c��Na+����c��H+������D����ΪC��

 Ӧ�����������Ĵ���ѧ������ϵ�д�
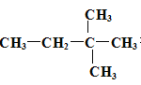
Ӧ�����������Ĵ���ѧ������ϵ�д�����Ŀ�����ݱ��������ķ���ʽ���й��ɣ��жϿո���������ͬ���칹����Ŀ���ǣ���˳���칹��
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
CH4 | C2H4 | C3H8 | C5H12 | C6H12 | C7H16 | C8H16 |
A. 6B. 5C. 4D. 3