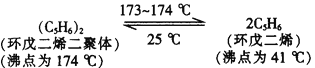��Ŀ����
����Ŀ��A��B��C��D��E��F���ֶ���������Ԫ�أ�ԭ������������������B�ĵ����ڳ�����Ϊ˫ԭ�ӷ��ӣ�����A�ĵ��ʿ��γɷ���X��X��ˮ��Һ�ʼ��ԣ�D�ļ���������X������ͬ����������D��ͬ�����м����Ӱ뾶��С��Ԫ�أ�EԪ�ص�ԭ�������ȴ�������������ӣ�C��F����Ԫ�ص�ԭ������㹲��13�����ӡ���
(1)A��Ԫ�ط���______________��D��Ԫ������ ____________��
(2)C�����ڱ��е�λ�ã�___________��E�����ӽṹʾ��ͼ________��
(3)B��C��E�ֱ���A�γɵĻ����������ȶ�����________(д��ѧʽ)��E��F������������Ӧ��ˮ��������Խ�ǿ����________(д��ѧʽ)
(4)F�ĵ����ڷ�Ӧ�г������������õ��ʵ�ˮ��Һ��E�ĵͼ������ﷴӦ�����ӷ���ʽΪ________________��
(5)X�ڴ�����C�����п�������ȼ�գ�����B�ĵ��ʡ��÷�Ӧ�Ļ�ѧ����ʽΪ��__________________��
���𰸡�H �� �ڶ�������A��  H2O HClO4 SO2 + Cl2 + 2H2O =2Cl��+4H++SO42�� 4NH3+3O2(����)
H2O HClO4 SO2 + Cl2 + 2H2O =2Cl��+4H++SO42�� 4NH3+3O2(����)![]() 2N2+6H2O
2N2+6H2O
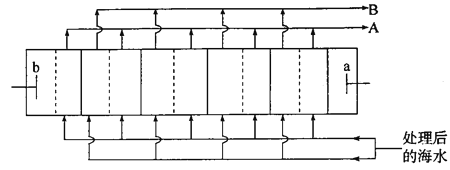
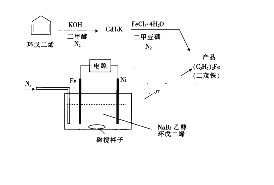
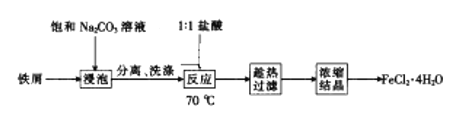
��������
A��B��C��D��E��F���ֶ���������Ԫ�أ�ԭ������������������B�ĵ����ڳ�����Ϊ˫ԭ�ӷ��ӣ�����A�ĵ��ʿ��γɷ���X��X��ˮ��Һ�ʼ��ԣ� A��ԭ��������BС����BΪNԪ�أ�AΪHԪ�أ�XΪNH3��D�ļ���������X������ͬ��������D�ļ�������Ϊ10e-�ṹ����D��ͬ�����м����Ӱ뾶��С��Ԫ�أ���DΪAlԪ�أ�EԪ�ص�ԭ�������ȴ�������������ӣ�E��ԭ����������Al����E��3�����Ӳ㣬����������Ϊ6����EΪSԪ�أ�F��ԭ��������E����Ϊ����������Ԫ�أ���F��ClԪ�أ�C��F��Cl������Ԫ�ص�ԭ������㹲��13�����ӣ�C����������=13-7=6��C��ԭ��������AlС����CΪOԪ�أ����Ԫ�ض�Ӧ�ĵ��ʡ�����������ʽ����⡣
��1��������������AΪ�⣬Ԫ�ط���ΪH��D��Ԫ������Ϊ�����ʴ�Ϊ��H������
��2��CΪO��ԭ������Ϊ8�������ڱ��еڶ�����VIIA����EΪ�������ӽṹʾ��ͼΪ ���ʴ�Ϊ���ڶ�����VIIA����
���ʴ�Ϊ���ڶ�����VIIA���� ��
��
��3��B��C��E�ֱ���A�γɵĻ�����ֱ���NH3��H2O��H2S���ǽ���Խǿ���⻯��Խ�ȶ����ǽ�����O��N��S�������⻯���ȶ���H2O��NH3��H2S����H2O���ȶ���EΪ��FΪ�ȣ��ǽ�����Խǿ������������Ӧ��ˮ��������Խǿ�����Խ�ǿ����HClO4���ʴ�Ϊ��H2O��HClO4��
��4����ˮ���������Ӧ������������ᣬ��Ӧ�����ӷ���ʽΪ��SO2 + Cl2 + 2H2O =2Cl-+4H++SO42-���ʴ�Ϊ��SO2 + Cl2 + 2H2O =2Cl-+4H++SO42-��
��5��������������ȼ�����ɵ�����ˮ����Ӧ����ʽΪ��4NH3+3O2(����)![]() 2N2+6H2O���ʴ�Ϊ��4NH3+3O2(����)
2N2+6H2O���ʴ�Ϊ��4NH3+3O2(����)![]() 2N2+6H2O��
2N2+6H2O��

����Ŀ����һ�̶��ݻ����ܱ������н��������·�Ӧ�� CO2(g) + H2(g) ![]() CO(g) + H2O(g) ��ƽ�ⳣ���˺��¶�t�Ĺ�ϵ���£�
CO(g) + H2O(g) ��ƽ�ⳣ���˺��¶�t�Ĺ�ϵ���£�
t�� | 700 | 800 | 850 | 1000 | 1200 |
K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
��1��K�ı���ʽΪ��____��
��2���÷�Ӧ������ӦΪ___��Ӧ������������������������
��3������ѡ���п���Ϊ�÷�Ӧ��850��ʱ�Ѿ��ﵽ��ѧƽ��״̬�ı�־���ǣ�_________
A��������ѹǿ���ٱ仯���� B�����������COŨ�Ȳ��ٱ仯
C�����������ܶȲ��ٱ仯 ���� D��c(CO2) = c(CO)= c(H2) = c(H2O)��
��4�����¶�Ϊ850����ijʱ�̲�ø��¶��µ��ܱ������и����ʵ����ʵ������±���
CO | H2O | CO2 | H2 |
0.5 mol | 8.5 mol | 2.0 mol | 2.0 mol |
��ʱ�����ķ�Ӧ�������淴Ӧ���ʵĹ�ϵʽ��___________������ţ���
A��v(��)��v(��) B��v(��)��v(��) C��v(��)��v(��) D�����ж�
��5����700��ͨ��ѹ�������������ѹǿ����÷�Ӧ��H2(g)��ת����___����������������С������������������ҵ�����У�ͨ���˷���ʹ����������ѹǿ�����Լӿ췴Ӧ��ȴ���ⷢ��H2(g)��ת����Ҳ������ߣ������ƽ��ԭ��������ԭ��________��
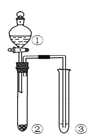
����Ŀ��������ͼ��ʾװ�ý�������ʵ�飬�ܵó���Ӧʵ����۵���( )
ѡ�� | �� | �� | �� | ʵ����� | ʵ��װ�� |
A | ϡ���� | Na2S | AgNO3��AgCl����Һ | Ksp(AgCl)��Ksp(Ag2S) |
|
B | Ũ���� | ���� | ��ˮ | Ũ���������ˮ�ԡ������� | |
C | ϡ���� | Na2SO3 | Ba(NO3)2 ��Һ | SO2������Ա��ξ��������ɰ�ɫ���� | |
D | Ũ���� | Na2CO3 | Na2SiO3��Һ | ���ԣ����̼����� |
A. A B. B C. C D. D